Ізобаричне перетворення відбувається, коли газ знаходиться під постійним тиском. Наприклад, якщо це зробити у відкритому середовищі, перетворення буде ізобарним, оскільки тиск буде таким атмосферним тиском, який не зміниться.
У цьому випадку температура і об’єм змінюються. Два провідні вчені вивчали, як відбувається ця зміна в ізобаричних перетвореннях. Першим, що зв'язав об'єм і температуру газів, був Жак Шарль (1746-1823), в 1787 році, а потім, у 1802 році, Джозеф Гей-Люссак (1778-1850) дав кількісну оцінку цих зв'язків.
Таким чином, з’явився закон, що пояснює ізобаричні перетворення газів, який став відомим як закон Чарльза / Гей-Люссака. Це зазначено наступним чином:
"У системі постійного тиску об'єм фіксованої маси газу прямо пропорційний температурі".

Це означає, що якщо ми подвоїмо температуру, об’єм газу також подвоїться. З іншого боку, якщо ми зменшимо температуру, обсяг газу також зменшиться в тій же пропорції.
Це можна побачити на дуже простому експерименті. Якщо ми помістимо повітряну кулю в горлечко пляшки, фіксована маса повітря потрапить у пастку. Якщо ми зануримо цю пляшку в миску з крижаною водою, повітряна куля здується. Тепер, якщо ми помістимо його в миску з гарячою водою, повітряна куля наповниться.
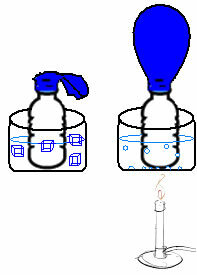
Це пов’язано з тим, що зі збільшенням температури кінетична енергія молекул газу зростає, і швидкість, з якою вони рухаються, також зростає. Таким чином, газ розширюється, збільшуючи об’єм, який він займає, і повітряна куля надувається. Навпаки відбувається, коли ми знижуємо температуру, поміщаючи її в холодну воду.
Цей взаємозв'язок між температурою та об'ємом в ізобаричних перетвореннях задається наступним співвідношенням:
V = k
Т
"k" - константа, як видно з наступного графіку:
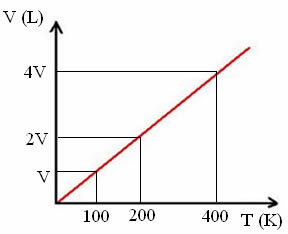
Зверніть увагу, що співвідношення V / T завжди дає константу:
_V_ =_2V_ = _4V_
100 200 400
Таким чином, ми можемо встановити такий взаємозв'язок для ізобаричних перетворень:
Vпочатковий = VОстаточний
Тпочатковий ТОстаточний
Це означає, що коли відбувається якась зміна температури газу при постійному тиску, ми можемо знайти його об’єм за допомогою цього математичного виразу. Вірно і навпаки, знаючи об’єм газу, ми з’ясовуємо, при якій температурі він знаходиться. Дивіться приклад:
"Газова маса займає об’єм 800 см3 при -23 ° C, при заданому тиску. Яка температура реєструється, коли газоподібна маса за однакового тиску займає об'єм 1,6 л? "
Дозвіл:
Дані:
Vпочатковий = 800 см3
Тпочатковий = -23 ºC, додаючи до 273, ми маємо 250 К (Кельвін)
VОстаточний = 1,6 л
ТОстаточний = ?
* Спочатку ми повинні залишити гучність на тій же одиниці. Відомо, що 1 дм3 дорівнює 1 літру. як 1 дм3 - це те саме, що 1000 см3, виявляється, що 1 літр = 1 000 см3:
1 л 1000 см3
х 800 см3
х = 0,8 л
* Тепер ми замінюємо значення формули і знаходимо кінцеве значення температури:
Vпочатковий = VОстаточний
Тпочатковий ТОстаточний
0,8_ = 1,6
250 тОстаточний
0,8 ТОстаточний = 250. 1,6
ТОстаточний = 400
0,8
ТОстаточний = 500K
* Переходячи до шкали Цельсія, ми маємо:
T (K) = T (° C) + 273
500 = T (° С) + 273
T (° С) = 500 - 273
Т (° С) = 227 ° С
Дженніфер Фогача
Закінчив хімію
Джерело: Бразильська школа - https://brasilescola.uol.com.br/quimica/transformacao-isobarica.htm


