Ентропія це міра ступеня розладу системи, що є мірою недоступності енергії.
Це фізична величина, яка пов’язана з Другий закон термодинаміки і що вона, як правило, приростає у Всесвіті.
Визначення ентропії
„Розлад” не слід розуміти як „безлад”, а скоріше як форму організації системи.
Поняття ентропії іноді застосовується в інших галузях знань із таким почуттям розладу, яке наближається до здорового глузду.
Наприклад, уявімо три банки, одна з маленькими блакитними кульками, інша з таким же типом куль, але червоною, а третя порожня.
Беремо порожній горщик і кладемо знизу всі сині кульки, а зверху всі червоні кульки. У цьому випадку кульки відокремлюються і упорядковуються за кольором.
Струшуючи горщик, кульки почали змішуватися таким чином, що в даний момент вже не було початкового поділу.
Навіть якщо ми продовжуємо струшувати горщик, навряд чи кулі повернуться до тієї самої початкової організації. Тобто впорядкована система (кульки, розділені кольором) перетворилася на невпорядковану систему (змішані кульки).

Таким чином, природною тенденцією є посилення розладу системи, що означає збільшення ентропії. Тоді можна сказати, що в системах: ΔS> 0, де S ентропія.
Також зрозумійте, що це таке ентальпія.
Ентропія та термодинаміка
Концепцію Ентропії почав розробляти французький інженер і дослідник Ніколас Саді Карно.
У своєму дослідженні щодо перетворення механічної енергії в теплову, і навпаки, він виявив, що неможливо існувати повністю ефективна теплова машина.
THE Перший закон термодинаміки в основному визначає, що "енергія зберігається". Це означає, що у фізичних процесах енергія не втрачається, вона перетворюється з одного типу в інший.
Наприклад, машина використовує енергію для роботи, і в цьому процесі машина нагрівається. Тобто механічна енергія деградується до теплової.
Теплова енергія знову не змінюється механічна енергія (якби це сталося, машина ніколи не зірветься), тому процес незворотній.
Пізніше лорд Кельвін доповнив дослідження Карно щодо незворотності термодинамічних процесів, поклавши початок Другий закон термодинаміки.
Рудольф Клаузіус першим застосував термін Ентропія в 1865 році. Ентропія буде мірою суми Термальна енергія які не можуть бути перетворені в механічну енергію (не можуть виконувати роботу) при певній температурі.
Клавзій розробив математичну формулу варіації ентропії () S), яка використовується в даний час.
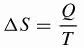
Бути,
ΔS: зміна ентропії (J / K)
Q: тепло, що передається (Дж)
T: температура (K)
Читайте теж:
- Термодинаміка
- Цикл Карно
- Енергія
- Види енергії
- Формули фізики
Розв’язані вправи
1) Енем - 2016 рік
До 1824 року вважалося, що теплові двигуни, прикладами яких є парові машини та поточні двигуни внутрішнього згоряння, можуть мати ідеальну роботу. Саді Карно продемонстрував неможливість теплової машини, що працює в циклах між двома джерелами тепла (одним гарячим та одним холодним), отримати 100% ефективність. Подібне обмеження відбувається, оскільки ці машини
а) виконувати механічні роботи.
б) виробляють підвищену ентропію.
в) використовувати адіабатичні перетворення.
г) суперечить закону енергозбереження.
д) працювати при тій же температурі, що і гаряче джерело.
Альтернатива: б) виробляють підвищену ентропію.
2) Енем - 2011 рік
Двигун може працювати тільки в тому випадку, якщо він отримує кількість енергії від іншої системи. У цьому випадку енергія, що зберігається у паливі, частково виділяється під час згоряння, щоб прилад міг функціонувати. Коли двигун працює, частина енергії, перетвореної або перетвореної при згорянні, не може бути використана для роботи. Це означає, що відбувається витік енергії в іншій формі. Карвальо, А. X. З.
Теплова фізика. Belo Horizonte: Pax, 2009 (адаптоване).
Згідно з текстом, перетворення енергії, що відбуваються під час роботи двигуна, зумовлені a
а) виділення тепла всередині двигуна неможливе.
б) робота, виконувана двигуном, некерована.
в) повне перетворення тепла в роботу неможливе.
г) перетворення теплової енергії в кінетику неможливе.
д) потенційне використання енергії палива не піддається контролю.
Альтернатива: в) повне перетворення тепла в роботу неможливе.
Дивіться теж: Вправи з термодинаміки



