У тексті "Заголовок або масовий відсоток”Ми побачили, як розрахувати співвідношення між масою розчиненої речовини та масою розчину для твердих, рідких та газоподібних розчинів. Однак у цьому тексті ми побачимо, що можна також розрахувати титр за об’ємом для розчинів з рідкими або газоподібними компонентами.

Заголовок за обсягом можна обчислити виразом:
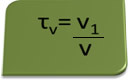
Розглянемо як приклад водний розчин етилового спирту, що використовується як антисептик і дезінфікуючий засіб, який був готується шляхом додавання 70 мл чистого спирту до такої кількості води, щоб довести об'єм 100 мл рішення. Отже, маємо:
τ = 70 мл = 0,7
100мл
Ми також можемо виразити заголовок у відсотках, просто помноживши результат на 100%. Отже, у цьому випадку ми маємо 70% розчин етилового спирту, це означає, що із кожних 100 об’ємних одиниць розчину 70 об’ємних одиниць - це спирт.
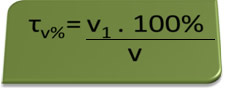
У наведеному нижче випадку ми маємо 70% розчин етилового спирту в обсязі 250 мл розчину; що означає, що 175 мл - це спирт, згідно з розрахунками:
100 мл 70 мл спирту
250 мл х
x = 70. 250
100
Х = 175 мл алкоголю

Однак ми не можемо сказати, що в цьому випадку ми маємо 75 мл (250-175) води. На відміну від масового титру, в якому ми можемо додати масу розчинника до маси розчиненої речовини, щоб знайти масу розчину, цього не можна зробити щодо об'ємного титру.

Це означає, що об’єм розчину не дорівнює сумі об’єму розчинника та об’єму розчиненої речовини (хоча часто різницю можна вважати незначною). Це пов’язано з тим, що міжмолекулярні сили, що існують у цих рідинах, впливають на кінцевий об’єм.
У випадку з вищезазначеним розчином етилового спирту, наприклад, коли ми змішуємо спирт з водою, відбувається скорочення загального обсягу розчину; тобто кінцевий об’єм буде меншим, ніж якщо б ми додали об’єм алкоголю та води. Це пов’язано з тим, що молекули алкоголю встановлюють зв’язки або водневі зв’язки з молекулами води, зменшуючи простір між ними.
Отже, в цьому та інших випадках об’єм розчину слід вимірювати експериментально, коли це не передбачено у вправі.
Процентний відсоток широко використовується у випадках з алкогольними напоями та комерційним алкоголем, як зазначалося вище. Дивіться два важливі програми цього розрахунку:
- Алкотестер: алкотестер вимірює концентрацію етилового спирту в крові, і в Бразилії заборонено їздити на будь-якому транспортному засобі із вмістом алкоголю в крові рівним або перевищує 0,1% за обсягом. Людина з таким вмістом алкоголю має на кожен літр крові 1 мл алкоголю, як показують такі розрахунки:
τv%=V1. 100%
v
0,1 % = V1. 100%
1л
V1 = 0,1% → V1 = 0,001 л = 1 мл
100%

- Вміст етанолу в бензині: у Бразилії бензин регулюється додаванням етанолу. Але вміст етанолу в бензині повинен становити не більше 24 об.% Безводного спирту (оскільки бензин повинен бути безводним). Чим більше етанолу додається до бензину, тим більше колір палива стає світлішим і збільшується його щільність.
Дженніфер Фогача
Закінчив хімію
Джерело: Бразильська школа - https://brasilescola.uol.com.br/quimica/titulo-volume-uma-solucao-quimica.htm
