Існує три типи алкадієнів або дієнів:
1-накопичений: Подвійні зв'язки розташовані на одному вуглеці і з'являються послідовно:
─C ═ Ç ═ C ─
│ │
2- Ізольовані: Подвійні зв'язки знаходяться на різних вуглецях і розділені принаймні двома послідовними одинарними зв'язками:
│
─C ═ C C ─ C ═ C ─
│ │ │ │ │
3- Кон'югати: Подвійні зв’язки з’являються по черзі, розділяючись єдиним одинарним зв’язком:
─C ═ C C ═ C ─
│ │ │ │
Прикладом важливого кон'югованого дієну є ізопрен, який є основною одиницею терпенової групи, класу органічних сполук. Дуже важливо, що деякими прикладами продуктів, утворених ізопренами, є каучук, бета-каротин (відповідальний за оранжевий колір морква), вітамін А та олії, що містяться у шкірках фруктів, насінні, квітках, листі, корінні, овочах та деревині, таких як лімонен та мірцен.
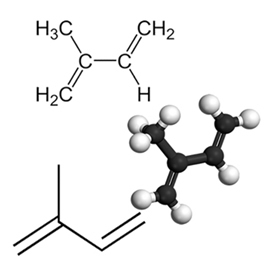
До накопичені та виділені дієни, виникають реакції приєднання як і у випадку з алкенами, що ви можете зрозуміти, прочитавши текст Реакції додавання. Різниця лише в тому, що дієни зазнають цього типу подвійної реакції, оскільки вони мають дві подвійні зв’язки, тоді як алкени мають лише одну подвійну зв’язок.
Однак у випадку з спряжені дієни, реакція приєднання має особливість, оскільки ці сполуки можуть зазнати резонансу, тому приєднання може відбуватися двома шляхами:
1- Додаток 1.2:
Це вважається нормальним додаванням, оскільки додавання відбувається на двох атомах вуглецю, які утворюють однаковий подвійний зв'язок, тобто на вуглецях 1 і 2:
H2Ç ═ СН─ СН ═ СН2 + HBr → H2C CH─ CH ═ СН2
│ │
HBr
Дивіться, що цей тип реакції слідує Правління Марковникова, водень зв’язується з більш гідрованим вуглецем (з більшою кількістю атомів водню).
Добавку 1,2 обробляють при низьких температурах (-60 ° С).
2- Додаток 1.4:
У цьому випадку реакція протікає при високих температурах. Важливо зазначити, що як продукт додавання 1,2, так і додавання 1,4 завжди утворюється, але температура вказує, який буде утворюватися у більшій кількості.
Нижче наведено приклад додавання типу 1.4:
H2Ç ═ СН─ СН ═ СН2 + HBr → H2C CH ═ CH─CH2
│ │
HBr
Зверніть увагу, що трапляється наступне, один із спільних електронів у пі-зв'язку кожного з подвійних вуглеців поділяються із заступником, а інші утворюють новий подвійний зв’язок між іншими вуглецями:
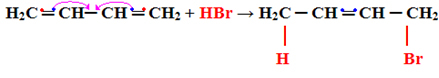
Дженніфер Фогача
Закінчив хімію
Джерело: Бразильська школа - https://brasilescola.uol.com.br/quimica/reacoes-adicao-dienos.htm
