Оскільки органічних сполук тисячі, явище ізомерії може мати кілька форм. Отже, ізомерію в основному можна класифікувати на два типи: плоска або конституційна ізомерія і космічна ізомерія або стереоізомерія. Кожен згаданий тип можна розділити, як показано на наступній схемі:
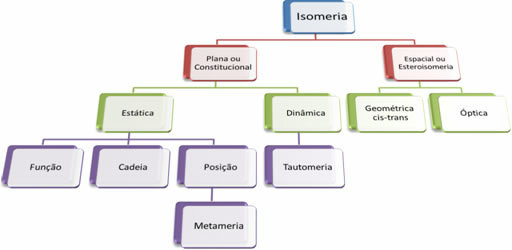
Дивіться кожен випадок:
1. Плоска або конституційна ізомерія: Ізомери цього типу мають однакову молекулярну формулу і відрізняються плоскими структурними формулами. Існує п’ять випадків плоскої ізомерії: функція, ланцюг, положення, метамерія та таутомерія.
1.1.Функціональна або функціональна ізомерія: Різниця між ізомерами полягає у функціональній групі.
Приклад: Молекулярна формула С3H6О
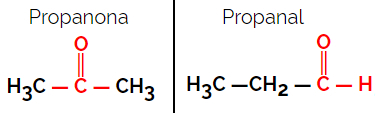
Зверніть увагу, що пропанон походить із кетонової групи, а пропанал - із альдегідної.
1.2. Ланцюгові або скелетні ізомери: Різниця між ізомерами полягає у типі ланцюга. Наприклад, один ізомер є з відкритим ланцюгом, а інший із замкнутим ланцюгом, або один із нормальним ланцюгом, а інший з розгалуженим ланцюгом, або один є однорідним ланцюгом, а інший - гетерогенним ланцюгом.
Приклад: Молекулярна формула С4H10
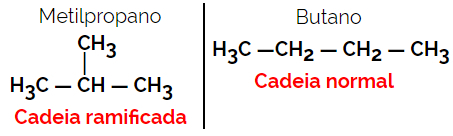
1.3.Позиційна або позиційна ізомерія: Різниця полягає в положенні ненасиченості, функціональної групи, гетероатома або заступника.
Приклад: Молекулярна формула С4H6

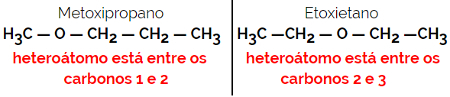
1.4.Компенсаційна ізомерія або метамерія: Це особливий тип позиційної ізомерії, де різниця полягає в положенні гетероатома.
Приклад: Молекулярна формула С4H10О
1.5.Динамічна ізомерія або таутомерія: Це особливий тип ізомерії функції, при якій ізомери співіснують у динамічній рівновазі в розчині. Два основні типи таутомерії - це між кетоном та енолом (кетоенольний баланс), а також між альдегідом та енолом (баланс альдоєнолу).
Приклад: Молекулярна формула С3H6О
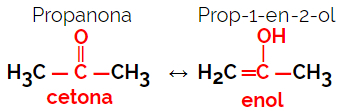
2. Космічна ізомерія або стероізомерія: У цьому випадку різницю між ізомерами можна візуалізувати лише через орієнтацію їх атомів у просторі. Існує два типи стереоізомерії: геометрична ізомерія та оптична ізомерія.
2.1.Геометричні або цис-транс-ізомери: Різниця полягає в тому, що ізомер, названий як цис він має однакові вуглецеві ліганди в подвійному зв’язку або в циклічних сполуках на одній стороні площини. Ліганди ізомеру переклад знаходяться на протилежних сторонах.
Приклад: Молекулярна формула С2H2Кл2

Ці сполуки називаються стереоізомери.
2.2.Оптичний ізомер: Виникає, коли ізомери здатні відхиляти пучок поляризованого світла. Якщо він згинає поляризований промінь світла вліво, це леворотаційний ізомер, але якщо він згинається вправо, його називають праворуким ізомером.
Приклад:
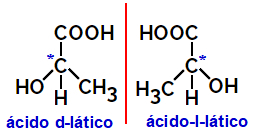
Асиметричні молекули, подібні показаним вище, які є дзеркальними зображеннями один одного і які не можна накласти, називаються енантіомери.
Дженніфер Фогача
Закінчив хімію
Джерело: Бразильська школа - https://brasilescola.uol.com.br/quimica/tipos-isomeria.htm
