ентропія - це величтермодинаміка асоціюється з незворотність станів фізичної системи. Це зазвичай асоціюється зі ступенем "розлад”Або“випадковість”Системи. Згідно з одним із тверджень 2-й закон термодинаміки:
“У теплоізольованій системі вимірювання ентропії повинно завжди збільшуватися з часом, до досягнення максимального значення ».
Іншими словами, ентропія здатний виміряти значення "стріла часу”Системи. Коли ми бачимо зображення нижче, ми інтуїтивно знаємо, що початковий стан системи представлений зображенням зліва, з найбільших організації:
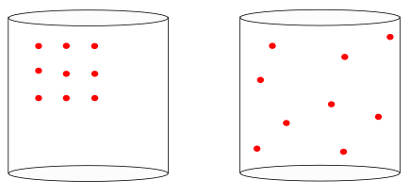
Переглядаючи попереднє зображення, ми знаємо, що найбільш вірогідною остаточною конфігурацією є та, в якій є атоми швидкості в усіх напрямках, так само, як випадкові позиції. Ось у чому полягає ентропія: а кратність станів системи завжди повинен збільшуватися.
Приклади
Яке з налаштувань нижче більш вірогідним дотримуватися при розташуванні цегли з часом?

У першій конфігурації кратність станів блоків дорівнює мало: всі вони розташовані в напрямкугоризонтальний
, паралельний один одного. З плином часу або дії агента очікується, що його конфігурація дорослішати в номер в Штатів, віддаючи перевагу Понеділокконформація, проілюстровано на зображенні праворуч. Можна навести інші приклади:Коли мішок з льодом поміщають в ємність з більшийтемператури, його температура зростає до досягнення тепловий баланс. У цей момент лід може танути. Повторно забираючи тепло з крижаної брили, яка зараз у штаті рідина, він може знову стати твердим, але його конформація не матиме тієї самої організації що представлені раніше.
Відкриваючи флакон духів, тепло може допомогти дифузія вашої молекули, розподіляючи вміст духів по всій довжині кімнати. Не можна очікувати протилежного, оскільки відведення тепла не сприятиме поверненню молекул у колбу.
Математичне визначення ентропії
THE математичне визначення ентропії задається відношенням кількості тепла (Питання), що передаються між двома частинами теплоізольованої системи, в джоулів (J), за своєю абсолютною температурою, в Кельвін (К):

S = Ентропія (J / K)
ΔQ = Кількість тепла (Дж)
Т = Абсолютна температура (K)
Визначення, наведене вище, справедливе для ізотермічні процеси, тобто в яких є теплообміни настільки малі (або повільні), що вони не здатні змінювати температуру системи. Отже, визначення ентропії є нескінченно малий (нескінченно мала частина).
Ми також можемо зрозуміти поняття ентропії так: будучи системою, утвореною двома порціями одного і того ж газу, в багато різнихтемператури, можна витягти деяку кількість робота з нього рухаються деякі поршень або ручний кривошип, наприклад. Однак через деякий час, частини цього газу, як правило, будуть баланстепловий. Якщо різниці в температурі більше не буде, навіть незважаючи на всю енергію, яка там присутня, вилучити її буде неможливо роботакорисний від нього.
Рафаель Хеллерброк
Закінчив фізику
Джерело: Бразильська школа - https://brasilescola.uol.com.br/o-que-e/fisica/o-que-e-entropia.htm
