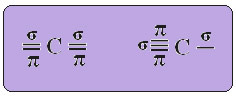
THE гібридизація вуглецю типу sp це трапляється лише тоді, коли він утворює два пі-зв’язки (π) та два сигма-зв’язки (σ). Тоді в цьому випадку є дві можливості: вуглець може утворити дві подвійні зв’язки або одинарну та потрійну зв’язки, як показано нижче:
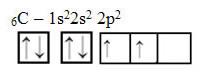
Текст "гібридизація типу sp3”Детально показує, як відбувається гібридизація вуглецю. Пам’ятаючи: гібридизація - це “змішування” чистих атомних орбіталей, які походять з гібридних атомних орбіталей, еквівалентних одна одній, але відмінних від вихідних чистих орбіталей. Отже, це відбувається на вуглецевих орбіталях, які спочатку були представлені так:
Однак, з отриманням енергії, електрон (представлений стрілкою) з 2s-орбіталі переходить на 2p-орбіталь:
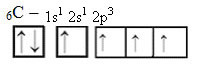
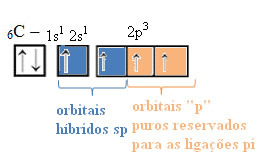
Таким чином, вуглець має чотири неспарених орбіталі, завдяки чому може утворювати чотири ковалентні зв’язки, а не лише два.
У разі гібридизації типу sp ми знаємо, що два зв’язки будуть pi; вони трапляються на чистих “р” -орбіталях, тоді як дві інші орбіталі, які є sp-гібридами, зроблять решту сигма-зв’язків.
Просторове представлення цієї гібридизації між орбіталлю s та p, що породжує гібридну орбіталь sp, може бути представлене наступним чином:
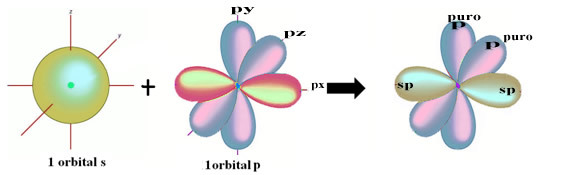
На малюнку вище дуже ясно, що є дві чисті орбіталі, які утворюватимуть пі-зв’язки.
Щоб ви зрозуміли, як це відбувається, візьмемо як приклад молекулу ціаністого газу (HCN), яка використовується в США в газових камерах для засуджених до смертної кари. Його структурна формула дається:
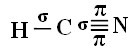
Що стосується вуглецю, то його атомні орбіталі вже були показані, тепер розглянемо водневі та азотні орбіталі:
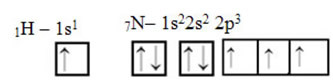
Зверніть увагу, що непарною водневою орбіталлю, яка буде виконувати сигма-зв'язок, є "s", яка просторово представлена колом; а азотні орбіталі мають тип «р», представлений трьома подвійними яйцевидами (кожна в просторовому полі: x, y, z). Таким чином, структура молекули HCN представлена наступним чином:
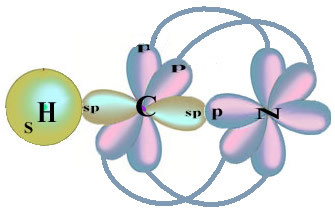
Що стосується типу зв’язків, що існують у цій структурі формальдегіду, ми маємо:
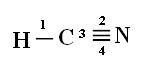
Зв'язки: 1 = σs-sp
2 = σp-sp
3 = 4 = πр-р
Дженніфер Фогача
Закінчив хімію
Джерело: Бразильська школа - https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp.htm
