Деякі сполуки не повинні мати вісім електронів у валентній оболонці для досягнення стабільності, тому вони вважаються винятками з правила Октету. Дізнайтеся зараз, чому деякі елементи уникають обов'язку мати октет електронів в останній оболонці.
Берилій (Будь)
Це виняток із Правила Октету, оскільки він здатний утворювати сполуки з двома одинарними зв’язками, тому стабілізується лише за допомогою чотирьох електронів у валентній оболонці. 
Оскільки водень (Н) повинен віддавати два електрони, щоб створити зв'язок (Н - Ну - Н), атом берилію (Be) ділиться своїми електронами і досягає стабільності.
Алюміній (Al)
Це виняток із Правила Октету, оскільки воно досягає стабільності за допомогою шести електронів у валентній оболонці. Атом алюмінію має тенденцію віддавати свої електрони і тому може утворювати три одинарні зв’язки з іншими атомами: 
У цьому випадку алюміній (Al) утворює три зв’язки з трьома атомами фтору (F).
Бор (B)
Він утворює молекулярні речовини з трьома одинарними зв’язками. 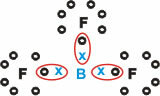
Зверніть увагу, що бор (B) має тенденцію віддавати свої електрони атомам фтору (F), який підпорядковується правилу октету, вимагаючи восьми електронів у валентній оболонці. Коли бор віддає свої електрони, фтор стабілізується з утвореним октетом.
Лірія Алвес
Закінчив хімію
Шкільна команда Бразилії
Побачити більше!
Теорія октетів
Загальна хімія - Хімія - Бразильська школа
Джерело: Бразильська школа - https://brasilescola.uol.com.br/quimica/excecoes-regra-octeto.htm
