У багатьох ліках, а також у рідких і твердих харчових продуктах, таких як оцет і печиво, наприклад вміст у відсотках маси розчиненої речовини (м1) по відношенню до маси всього розчину (m = m1 + м2). Ця величина називається Заголовок (Т) або масовий відсоток розчину.
Його визначення можна висловити наступним чином:

Таким чином, його обчислення здійснюється за допомогою математичного рівняння нижче:
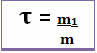
або

Оскільки і знаменник, і чисельник мають справу з однією і тією ж одиницею (одиницею маси є грам - г), Заголовок не має одиниці і становить менше 1.
Таким чином, якщо ми говоримо, що назва даного розчину дорівнює 0,4, це означає, що для кожної одиниці маси розчину 0,4 відповідає масі розчиненої речовини. Однак заголовок часто виражається у відсотках. Для цього просто помножте знайдене значення на 100%. У цьому випадку це називається Масовий відсоток (Т%) *
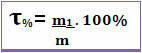
Зверніть увагу на малюнок нижче, на якому вказано масовий відсоток хлориду натрію в сольовому розчині:

Фізіологічний розчин, що застосовується при лікуванні зневоднення, містить масовий відсоток хлориду натрію 0,9%
У цьому випадку це означає, що на кожні 100 г або 100 одиниць цього розчину припадає 0,9 г або 0,9% розчиненої речовини, тобто хлориду натрію (NaCl - кухонна сіль).
Інший приклад - оцет: на його етикетці є вказівка на те, що для його приготування було використано 5% маси оцтової кислоти, тобто на кожні 100 г розчину припадає 5 г цієї кислоти.

Заголовок також можна вказати в об'ємний відсоток. У цьому випадку різниця лише в тому, що замість того, щоб співвідносити масу розчиненої речовини з масою розчину; об'єм розчиненої речовини пов'язаний з об'ємом розчину згідно з наступною формулою:
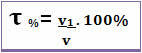
Наприклад, у випадку звичайного алкоголю, який має об'ємний відсоток 96%, у 100 мл розчину 96 мл - це спирт.

* Термін "Назва" частіше використовується серед науковців, тоді як техніки та кілька авторів книг частіше використовують вираз "Масовий відсоток".
Дженніфер Фогача
Закінчив хімію
Джерело: Бразильська школа - https://brasilescola.uol.com.br/quimica/titulo-ou-porcentagem-massa.htm
