Реакція окислення-відновлення характеризується як одночасний процес втрати та виграшу електронів, оскільки електрони, втрачені атомом, іоном або молекулою, негайно приймаються іншими.
Щоб зрозуміти, див. Приклад:
Розчин мідного купоросу (CuSO4 (вод.)) синій через наявність іона Cu2+ розчинений у ній. Якщо ми покладемо металеву цинкову пластину (Zn(s)) у цьому розчині з часом ми можемо помітити дві зміни: колір розчину стане безбарвним, а на цинковій пластині з’явиться металевий осад міді.
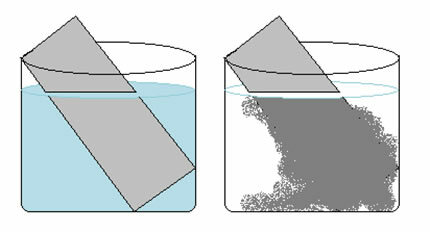
Отже, реакція, яка виникає в цьому випадку, така:
Zn(s) + CuSO4 (вод.) → Cu(s) + ZnSO4 (вод.)
або
Zn(s) + Cu2+(тут) + ОС42-(тут) → Cu(s) + Zn2+(тут) + ОС42-(тут)
чи ще
Zn(s) + Cu2+(тут) → Cu(s) + Zn2+(тут)
Зверніть увагу, що відбувся перехід електронів з цинку в мідь. Аналізуючи ізольовано перетворення, що відбулося в кожному з цих елементів, маємо:
- Zn(s) → Zn2+(тут)
Цинк втратив 2 електрони, переходячи від металевого цинку до катіону. В такому разі, цинк зазнав окислення.
- Дупу2+(тут) → Cu(s)
З міддю сталося навпаки, вона набрала 2 електрони, переходячи від катіона міді II до металевої міді. Мідь була зменшена.
Це пояснює дві спостережувані зміни, оскільки розчин став безбарвним, оскільки іони міді перетворювались на металеву мідь, яка осідала на цинковій пластині.
Оскільки спостерігалася одночасна втрата та приріст електронів, ця реакція є прикладом окисно-відновної реакції, і через нього ми можемо встановити наступні поняття, які повторюються для всіх інших реакцій цього тип:

Найреактивніший метал зазнає окисленняТаким чином, у пропонованому прикладі цинк є більш реакційноздатним, ніж мідь.
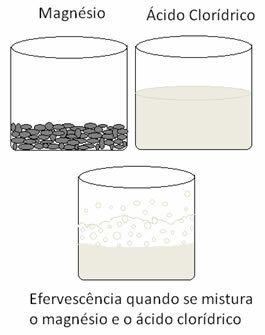
Ще одна окислювально-відновна реакція, яку можна цитувати, відбувається, коли ми вводимо магній або алюміній у розчин соляної кислоти. У цих реакціях водень із соляної кислоти отримує 3 електрони з алюмінію (або 2 електрони з магнію), передаючи його від катіона Н+ для газоподібного водню (H2), тоді як метал стає катіоном:
2 Ал(s) + 6 год+(тут) → 2 Ал3+(тут) + 3Н2 (г)
мг(s) + 2 год+(тут) → Mg2+(тут) + H2 (г)
Метали зазнають окислення, а водень - відновлення. Нижче наведено рисунок, який показує, що додавання магнію до соляної кислоти спричинює а шипучість, яка обумовлена виділенням газоподібного водню, а магній зникає, як і є споживаний.
Дженніфер Фогача
Закінчив хімію
Джерело: Бразильська школа - https://brasilescola.uol.com.br/quimica/reacoes-oxirreducao.htm



