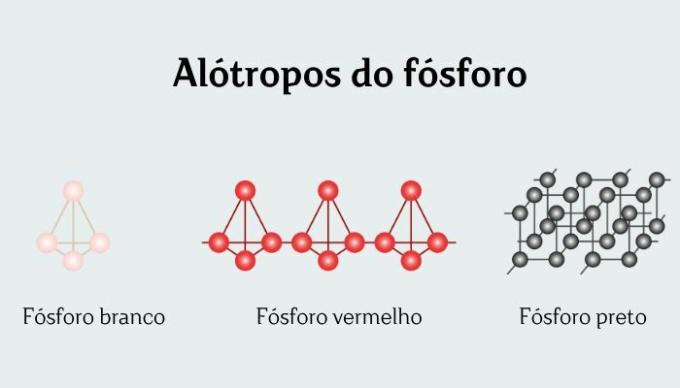
Білий фосфорє алотропною формою хімічного елемента фосфору, зазвичай представлений молекулярною формулою P4. Незважаючи на те, що його називають білим фосфором, його колір більше нагадує віск або жовтуватий. Білий фосфор вважається найстабільнішою формою фосфору, хоча він не є найбільш термодинамічно стабільним.
Білий фосфор має небагато прямих застосувань у промисловості, як правило, перетворюється на червоний алотроп, який має більш пряме використання та менш токсичний. Однак білий фосфор використовується у військових конфліктах як засіб, що викликає дим, для освітлення, а також створювати пожежі, оскільки білий фосфор запалюється при контакті з повітрям і при температурі трохи вище 30 °C.
Читайте також: Які алотропні форми сірки?
Теми в цій статті
- 1 - Зведення білого фосфору
- 2 - Що таке білий фосфор?
- 3 - Склад білого фосфору
- 4 - Для чого використовується білий фосфор?
-
5 - Використання білого фосфору на війні
- → Бомба з білим фосфором
- → Наслідки впливу білого фосфору
- 6 - Відмінності між білим фосфором і червоним фосфором
Короткий опис білого фосфору
- Білий фосфор - це алотропна форма фосфору, представлена формулою P4.
- Має жовтуватий колір, близький до кольору воску.
- Його можна виробляти з фосфатних порід, піску та коксу при високих температурах.
- Він дуже погано розчинний у воді і займається при температурі трохи вище 30°C.
- Він не має широкого застосування в промисловості, але є основною елементарною формою виробленого фосфору.
- Його використовують у конфліктах і війнах як засіб, що викликає дим, пожежі та для освітлення.
- Він має більш пряме застосування, ніж білий фосфор, і також менш токсичний, ніж він.
Що таке білий фосфор?
Білий фосфор є однією з 12 існуючих алотропних форм хімічний елемент фосфор, зазвичай представлений як P4.
У давні часи сеча була єдиним відомим джерелом елемента фосфору і, отже, всі дослідження цього елемента посилалися на виробництво з сечею. Фосфор, утворений у цьому процесі, мав білий (або жовтуватий, схожий на віск) колір, викликаючи що білий фосфор був першою алотропною формою цього елемента, що також збільшило його слава.
ззаду, У другій половині 19 століття було виявлено, що білий фосфор можна отримати шляхом нагрівання фосфатних порід., з піском і коксом. Цей метод був удосконалений для сучасного способу виробництва білого фосфору, який полягає у використанні a електрична піч (яка досягає температур у діапазоні від 1400 до 1500 °C) для нагрівання фосфоритної породи (Тут3(ПИЛ4)2), пісок (кремнезем, SiO2) і кокс (вуглець).
2Ca3(ПИЛ4)2 + 6 SiO2 + 10 С → П4 + 6 CaSiO3 + 10 CO
Пари фосфору конденсуються, утворюючи воскоподібну тверду речовину, нерозчинну у воді.
Не зупиняйся зараз... Після реклами буде більше ;)
Склад білого фосфору
Білий фосфор традиційно є найбільш стабільною формою фосфору, хоча він, по суті, метастабільний (його нагрівання призводить до термодинамічно більш стабільних алотропних форм, червоного і чорного).
Він з'являється в кристалічній формі у вигляді молекул P4 тетраедр із зв'язками P─P довжиною 221 пм. Розчинний у бензолі, PCl3 та К.С.2, дуже мало розчинний у воді. Насправді білий фосфор зберігається у воді, щоб запобігти її окисленню.
У вологому повітрі він піддається хемілюмінесцентному окисленню, випромінюючи зелене світіння та повільно перетворюючись на P4О8 і3.
Чим корисний білий фосфор?
Білий фосфор має широке застосування у військовій промисловості, як димоутворювач і для заправки снарядів і гранат.
У промисловості загалом його виробляють у вигляді елементарного фосфору з фосфатних порід, щоб потім перетворити на червоний фосфор., інша алотропна форма, яка має іншу хімічну поведінку. Червоний фосфор має широке загальне застосування, використовується для виробництва сірників, фосфіду алюмінію, антипіренів і для піротехнічних цілей. Білий фосфор також є основним способом виробництва сполук вищої чистоти, які можуть містити фосфор. Він також виробляє PCl3, через реакцію з Cl2.
Дивіться також: Зрештою, сірник у коробці чи на паличці?
Використання білого фосфору на війні
Білий фосфор зрештою використовується у військових цілях через його самозаймання при низьких температурах: вище 50 °C (деякі автори кажуть, що вище 34 °C), при контакті з повітрям білий фосфор запалюється, утворюючи п’ятиокис фосфору (П4О10).
→ Бомба з білим фосфором
Білий фосфор запалюється при низьких температурах. Ось чому, використання білого фосфору як запалювальної зброї є поширеним у конфліктах. Його використання базується не на смертоносності, а скоріше для створення вогню, освітлення чи навіть димової завіси, щоб допомогти військам у втечі чи відступі. Утворення диму відбувається, коли температура є достатньо високою по відношенню до температури початку самозаймання алотропної форми.

Оскільки існує вищезазначене використання білого фосфору (освітлення, димова завіса та сприяння пожежі), міжнародні конвенції не забороняють його використання під час конфліктів. Конвенція ООН про хімічну зброю (КХЗ) не вважає її хімічною зброєю. Єдина проблема полягає в тому, що якщо використовувати білий фосфор для безпосереднього підпалу людей проти цивільних цілей, він може порушити Протокол III Конвенції про певні види звичайної зброї (ККЗЗ). Проте цей факт має бути підтверджено розслідуванням компетентних органів.
→ Наслідки впливу білого фосфору
Після спалаху вогонь білого фосфору важко загасити. Дуже легко прилипає до шкіри та одягу, викликаючи значні опіки. Крім того, навіть після початкової обробки білий фосфор може знову спалахнути, якщо все ще контактувати з повітрям. Тому видалення будь-яких слідів фосфору з ран має важливе значення.
Спочатку промивання водою та сольовими розчинами є обов’язковим, оскільки це може не тільки зменшити температури, а також припинення горіння та видалення будь-яких слідів розбавленої фосфорної кислоти, яка може мати сформовано. Поглинання фосфору під час опіку може спричинити відхилення в рівнях кальцію та фосфору в організмі, що може швидко спричинити гіпокальціємія і гіперфосфатемія, що може бути причиною смертельна серцева аритмія.
Дим надзвичайно подразнює слизові оболонки, де з’єднується з водою з утворенням фосфорної кислоти. Вдихання диму білого фосфору викликає подразнення дихальних шляхів, що викликає кашель, головний біль і уповільнений набряк легенів.
Білий фосфор дуже токсичний для людини і швидко всмоктується в кров і печінку. Проковтування 100 мг може призвести до летального результату через печінкову недостатність. Повільне, тривале вплив малих кількостей також викликає жахливі наслідки. Найпоширенішим станом є матчова щелепа, яка вплинула на кількох робітників фосфорних заводів наприкінці 19 і на початку 20 століття.
Відмінності між білим фосфором і червоним фосфором
Білий і червоний фосфор є різними алотропними формами хімічного елемента фосфору, обидва представлені П4.
Червоний фосфор можна отримати з білого фосфору шляхом нагрівання його в інертній атмосфері при температурі в діапазоні 540 K (267 °C). Вперше його отримав Антон фон Шоттер у 1845 році.
Існує кілька кристалічних форм червоного фосфору. Одним з них є Хітторф (також відомий як фіолетовий фосфор), який складається з довгого і складного фосфорного ланцюга.
Червоний фосфор менш щільний, ніж білий, має вищу температуру плавлення і менш реакційноздатний. Крім того, червоний фосфор також не вважається токсичним, що робить його легшим і безпечнішим у роботі.
Джерела
ЧОУ, Т.-Д.; ЛІ, Т.-В.; ЧЕНЬ, С.-Л.; ТУНГ, Ю.-М.; ДАІ, Н.-Т.; ЧЕНЬ, С.-Г.; ЛІ, К.-Х.; ЧЕНЬ, Т.-М.; ВАНГ, Х.-Ж. Лікування опіків білим фосфором. Опіки, п. 27, стор. 492-497, 2001.
HOUSECROFT, C. І.; ШАРП, А. Г. Неорганічна хімія. 2. вид. Pearson Education Limited: Лондон, 2005.
Келлі, П. Ф. Фосфор: неорганічна хімія. в: Енциклопедія неорганічної хімії. 2. вид. Wiley: Нью-Джерсі, 2005.
ВСЕСВІТНЯ ОРГАНІЗАЦІЯ ОХОРОНИ ЗДОРОВ’Я. Білий фосфор. Всесвітня організація охорони здоров'я, 20 жовт. 2023. Доступний у: https://www.who.int/news-room/fact-sheets/detail/white-phosphorus.
Чи хотіли б ви посилатися на цей текст у шкільній чи навчальній роботі? Подивіться:
НОВАЙС, Стефано Араухо. «Білий фосфор»; Бразильська школа. Доступний у: https://brasilescola.uol.com.br/quimica/fosforo-branco.htm. Перевірено 9 листопада 2023 р.