Лоренцо Романо Амедео Карло Авогадро (1776-1856) - італійський хімік, який вперше встановив ідею, що зразок елемента, маса якого в грамах чисельно дорівнює його атомній масі, завжди має однакову кількість атомів (N).
Сам Авогадро не зміг визначити значення Н. Однак впродовж ХХ століття розвиток технологій та наукових знань дало можливість іншим вченим розробляти методи їх визначення. Коли це значення нарешті було виявлено, його викликали Константа Авогадро, на честь цього вченого, оскільки саме він заклав основи його створення.

Лоренцо Романо Амедео Карло Авогадро (1776-1856)
В 1 молі будь-якої сутності (атоми, молекули, електрони, формули чи іони) міститься саме значення константи Авогадро.
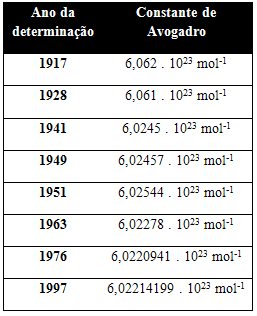
У таблиці нижче наведені деякі значення константи Авогадро, отримані протягом ХХ століття:
Ось деякі методи, що використовуються для спроби визначити значення константи Авогадро:
Першим вченим, який зробив приблизний розрахунок константи Авогадро, був Йоганн Йозеф Лошмідт. У 1867 році він спирався на кінетичну теорію газів і визначив, скільки молекул існує в 1 см3 газу.
Іншим із цих вчених був француз Жан Батіст Перрен (1870-1942), який підраховував кількість колоїдних частинок в одиниці об'єму в суспензії та вимірював їх маси. Значення, яке він знайшов, становило від 6,5 до 7,2. 1023 утворень на моль. Цей вчений опублікував книгу в 1913 році Les Atomes (1-е видання Париж: Алкан), і його 9-е видання, опубліковане в 1924 році, містило 16 способів експериментального отримання константи Авогадро.

Жан Батіст Перрен (1870-1942)
Роками пізніше вчений Джеймс Дьюар (1842-1923) використав метод, розроблений роками раніше радіохіміком Бертрамом Болтвудом (1870-1927) та фізиком Ернестом Резерфорда (1871-1937), який в основному складався з підрахунку альфа-частинок, випромінюваних радіоактивним джерелом, та визначення обсягу отриманого газу гелію. Значення, виявлене Дьюаром, становило 6,04. 1023 моль-1.
Ще в 20 столітті Роберт Міллікан (1868-1953) провів експеримент для визначення заряду електрона (1.6. 10-19 Ç). Оскільки заряд в 1 моль електронів був уже відомий (96500 С), можна було зв'язати ці два значення і знайти таке значення для константи Авогадро: 6.03. 1023 моль-1.
В даний час рекомендованим значенням для константи Авогадро є 6,02214 х 1023 моль-1 і це визначається за допомогою дифракції рентгенівських променів, при якій отримують об’єм кількох атомів кристалічної решітки, якщо відома щільність і маса 1 моль атомів у зразку.
З дидактичною метою у середній школі, де розрахунки не повинні бути настільки точними, як ті, що виконуються в хімічних лабораторіях, константа Авогадро вважається такою, що 6,02. 1023 моль-1.
Є також більш прості методи, які можуть бути використані, щоб допомогти студентам визначити константу Авогадро на практиці. Один з них - електроліз у водному середовищі.
Дженніфер Фогача
Закінчив хімію
Джерело: Бразильська школа - https://brasilescola.uol.com.br/quimica/determinacao-constante-avogadro.htm
