Нітросполука - органічна сполука, отримана в результаті хімічної реакції між азотною кислотою (HNO3) це алкан (насичений вуглеводень з відкритим ланцюгом) або ароматичний. Коли азотна кислота реагує з алканом або ароматичний, відбувається реакція заміщення, при якій кислота втрачає гідроксильну групу (ОН), а органічна сполука втрачає водень:
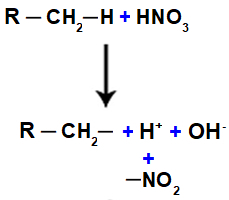
Далі ми маємо утворення молекули води, що є результатом об’єднання між OH і H, тоді як НІ групи2 (що залишився від кислоти) зв'язується з алканом або ароматичним, утворюючи нітросполука.
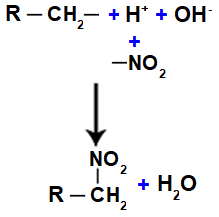
Уявлення про утворення води та нітросполук
Таким чином, основною структурною особливістю a нітросполука це наявність одного або декількох нітрогрупи (БІЛЯ2) пов'язаний з алканом або ароматичним.
властивості
З повагою до властивості фізичне, ми можемо виділити:
Загалом, це в'язкі рідини при кімнатній температурі (за винятком нітросполуки з низькою молярною масою, що є рідинами);
Вони мають високі температури плавлення і кипіння;
Вони щільніші за воду;
Загалом вони не розчиняються у воді, за винятком нітрометану та нітроетану;
Утворені аліфатичним ланцюгом, вони мають приємний аромат і не є отруйними. Тепер, якщо вони утворені ароматичним ланцюжком, вони отруйні та мають неприємний аромат;
О тип міжмолекулярної сили що об'єднує його молекули - це постійний дипол, оскільки вони мають полярні характеристики.
Щодо хімічних властивостей, ми повинні знати, що нітросполуки вони дуже реактивні, тобто використовуються в різних органічних реакціях, таких як реакції заміщення.
Офіційне номенклатурне правило, запропоноване IUPAC (Міжнародним союзом чистої та прикладної хімії), для нітросполуки é:
Нітро + префікс + інфікс + о
Примітка: Префікс пов’язаний із кількістю вуглецю, присутнього в ланцюзі нітросполук. Інфікс пов’язаний з типом зв’язків, що існують між вуглецями.
Приклади:
Номенклатура нітросполуки нормального ланцюга

Спочатку цікаво пронумерувати рядок нітросполука (завжди з вуглецю, найближчого до вуглецю, що має нітрогрупу):
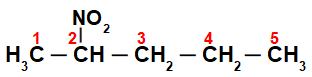
Нумерацією рядка нітросполука, маємо, що в ньому є п’ять атомів вуглецю (префікс pent), лише одинарні зв’язки між вуглецями (інфікс an) та нітрогрупою на вуглеці 2. Назва цієї структури - 2-нітропентан.
Номенклатура нітросполуки нормального ланцюга
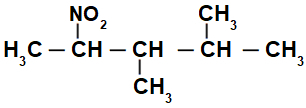
Структурна формула розгалуженої нітросполуки
Спочатку цікаво пронумерувати рядок нітросполука (завжди з вуглецю, найближчого до вуглецю, що має нітрогрупу), що йде до кінця, що має найбільшу кількість вуглецю для основного ланцюга:
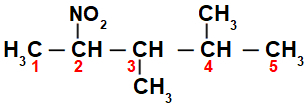
Нумерацією рядка нітросполука, ми маємо, що в ньому є 5 атомів вуглецю (префікс pent), лише поодинокі зв’язки між вуглецями (інфікс an), двома метильними радикалами (на вуглецевих номерах 3 і 4) та нітрогрупою на вуглеці 2. Назва цієї структури - 3,4-диметил-2-нітропентан.
Використовує
ти нітросполуки, загалом, їх можна використовувати у виробництві пестицидів, барвників, аніліну, бактерицидів, фунгіцидів, добавок, розчинників; вони також діють як вибухові речовини та при переробці нафти.
Мені Діого Лопес Діас
Джерело: Бразильська школа - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-nitrocomposto.htm
