Як пояснюється в тексті Реакції додавання, ці органічні реакції зазвичай відбуваються із сполуками, які мають ненасиченість (подвійні зв’язки або потрійних), в яких пі-зв'язок розірваний, дозволяючи входження атомів або груп атомів у ланцюг. вуглекислий.
Однак цей тип реакції зустрічається і у випадку циклоалкани (вуглеводні із замкнутим ланцюгом із лише насиченими (простими) зв’язками між вуглецями), які мають три або чотири атоми вуглецю. Зверніть увагу на приклад нижче, який являє собою бромування (реакція галогенування) циклопропану:
СН2
/ \ + бр2 → бр ─ СН2 ─ СН2 ─ СН2 ─ бр
H2C CH2
Так само існує реакція приєднання, яка називається гідрогалогенування або додавання галогеніду, як показано нижче:
СН2
/ \ + HBr → H ─ СН2 ─ СН2 ─ СН2 ─ бр
H2C CH2
Зверніть увагу, що в обох випадках молекула була розірвана і були отримані сполуки з відкритим ланцюгом.
Але це не так легко відбувається в циклоалканах з п’ятьма або більше атомами вуглецю. З іншого боку, ці сполуки, швидше за все, дають ефективність
реакції заміщення, в якому зв'язок не розірваний, а навпаки, один або кілька атомів водню, пов'язаних з вуглецем, замінюються атомами інших елементів.Циклопентан все ще може проводити реакції приєднання, але лише при більш високих температурах (близько 300 ° C). У випадку з циклогексаном це дуже важко. Насправді це реакції заміщення, такі як наступне хлорування:
СН2 СН2
/ \ / \
H2C CH2 H2C CH ─ Кл
│ │ + Кл2→ │ │ + HКл
H2C CH2 H2C CH2
\ / \ /
СН2 СН2
Кільця з п'ятьма і більше атомами вуглецю не реагують на додаток до реакцій із галогенводневими кислотами, такими як HBr.
Але чому це трапляється? Чому три- або чотиривуглецеві циклоалкани проводять реакції приєднання, а циклоалкани з більшою кількістю атомів вуглецю, як правило, не?
Ну, це тому, що циклопропан і циклобутан є більш нестабільними, тому легше розірвати їх зв’язки.
Йоганн Фрідріх Адольф фон Байєр (1835-1917)
Для пояснення цього німецький хімік Йоганн Фрідріх Адольф фон Байєр (1835-1917) розробив у 1885 р. Т.зв. Теорія кільцевих напружень, який показав це чотири зв'язки, утворені атомами вуглецю, були б більш стійкими, коли б мали кут, рівний 109º 28 ', як це відбувається з наступним метаном:

Чотири одинарні зв'язки метану мають кут 109º 28 '
Це найстабільніший кут, оскільки він відповідає якомога більшій відстані між атомами в тетраедричній геометрії. При цьому електронне відштовхування (відштовхування між електронами у валентних шарах атомів) стає меншим.
Циклоалкани з трьома, чотирма та п’ятьма вуглецевими атомами мають кути зв’язку між атомами вуглецю менше 109º 28 '. Подивіться:
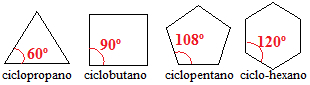
Кути циклоалканних зв’язків
Виходячи з цих реальних кутів, які ми можемо загалом назвати α, розрахунок напруги зв’язку можна виконати за такою формулою:
напруга = 109º 28' - α
2
Ми знаємо, що циклопропан є найбільш нестабільним, а також найбільш реакційноздатним циклоалканом, і це підтверджується розрахунком напруги його кільця порівняно з іншими:
напруга циклопропану = 109º 28' – 60º = 109º – 60º + 28' = 49º + 28' = 24,5º + 14
2 2 2
Оскільки 0,5º = 30, то маємо:
напруга циклопропану = 24º + 30 '+ 14' = 24º 44'
напруга циклобутану = 109º 28' – 90º = 9º 44'2
напруга циклопентану = 109º 28' – 108º = 0º 44'2
Згідно з теорією напруженості Баєра, чим більша ця напруга, тим більш нестабільним буде циклан, тобто тим більше різниця між реальним кутом (α) і теоретичним кутом (109º 28 '), більш нестабільним і, отже, більш реактивним буде речовина.
Ось чому циклопропан є найменш стабільним з циклоалканів.
Однак у теорії Баєра була помилка, тому що якщо ми продовжуватимемо робити цей розрахунок напруги для циклогексану, де кут з'єднання становить 120 °, ми побачимо, що значення буде навіть меншим, ніж значення циклопропану, даючи рівне -5 ° 16 '. Це вказує на той факт, що циклогексан повинен бути ще більш нестабільним і проводити реакції приєднання, що на практиці не буває.
Пояснення цьому факту знайшов у 1890 р. Німецький хімік Герман Закс, а в 1918 р. - німецький хімік Ернст Мор. На думку цих вчених, помилка теорії кільцевих напружень Баєра полягала б у тому, що він вважав, що всі циклоалкани є площинними, тобто всі їх атоми вуглецю знаходяться в одній площині, співпрацям креслення їх конструкцій, показані вище.
Однак насправді кільця циклоалканів з більш ніж п’ятьма атомами вуглецю є не плоскими, а їх атомами. набувають просторових конформацій, які скасовують напруження між з'єднаннями, встановлюючи кут 109 ° 28 'між Зв'язки.
Наприклад, розглянемо випадок циклогексану. Насправді він не є плоским з кутом 120 ° між зв’язками, а насправді його атоми «крутяться», утворюючи дві можливі конформації, конформацію «крісла» та «човна»:
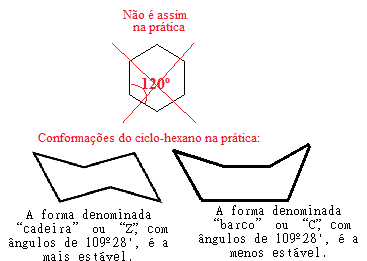
Можливі конформації циклогексану на практиці
Зверніть увагу, що оскільки реальний кут циклогексану дорівнює 109º 28 ', це дуже стійка сполука, тому її молекула не руйнується, не беручи участі в реакціях приєднання. Також зауважте, що форма "стільця" є найбільш стійкою, оскільки вона завжди переважає у сумішах оскільки в цій конформації атоми водню, зв’язані з вуглецем, знаходяться далі один від одного. інші.
Дженніфер Фогача
Закінчив хімію
Джерело: Бразильська школа - https://brasilescola.uol.com.br/quimica/teoria-das-tensoes-dos-aneis-bayer.htm

