THEосмос та прохід розчинника, від менш концентрованого розчину до більш концентрованого розчину через напівпроникна мембрана, поки тиск, який чинить розчин на мембрану, не перешкоджає проходженню розчинника. Цей процес призначений для збалансувати концентрацію розчину.
Читайте теж: Розчинена речовина та розчинник
осмотичний тиск
THE осмотичний тиск та тиск, що чиниться на розчин з більшою концентрацією так що осмос не відбувається, тобто так, щоб розчинник не перетинав напівпроникну мембрану.
Осмотичний тиск використовується в процесах опріснення води, форсуючи процес зворотний осмос, в результаті чого розчинник переходить з більш концентрованого розчину в менш концентрований. Ми називаємо цей процес зворотний осмос. Дивіться наступне зображення, яке порівнює два процеси:
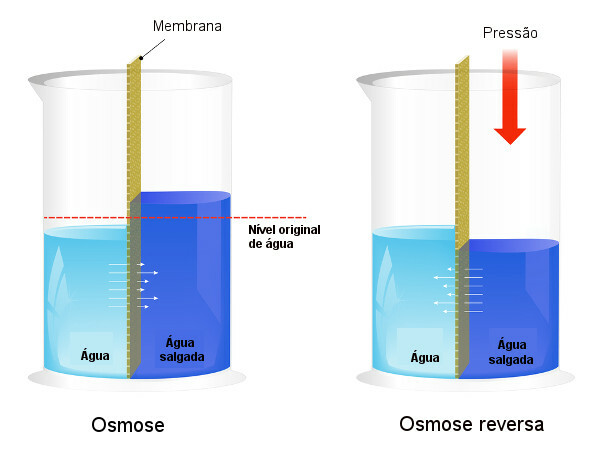
Зверніть увагу, що при осмосі проходження розчинника відбувається в напрямку найбільш концентрованого розчину, а при зворотному осмосі проходження відбувається в протилежному напрямку через прикладений тиск. Щоб дізнатись більше про тему, прочитайте наш текст:
осмотичний тиск.знати більше: Зворотний осмос при опрісненні морської води
рівняння осмотичного тиску
Осмотичний тиск, представлений літерою pi (π) розчину, можна обчислити за таким рівнянням:
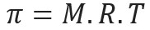
М = концентрація в моль / л
R = універсальна константа ідеальних газів
Т = абсолютна температура, в К
як інші колігативні властивості, осмотичний тиск залежить від концентрація розчину, тобто чим більша концентрація розчину, тим більший вплив осмосу на розчини і, отже, більший осмотичний тиск.
Приклади
Осмос з’являється у нашому повсякденному житті в різний час. Ми можемо навести приклад процес засолювання м’яса твоєму збереження. ти мікроорганізми це призвело б до деградації м’яса втратити водузсередини назовні, який має концентрацію солі, завдяки чому їжа довше зберігається.
Через сіль також буває, що листя салату в’януть за втрату води зсередини їх клітин (вид менш концентрований) для загартований розчин у зовнішньому середовищі.
Осмос також важливий, коли ми говоримо про крові людини. Ми говоримо, що Червоні клітини а кров одна ізотонічне середовище, тобто вони мають однаковий осмотичний тиск, що дозволяє з легкістю надходити і виходити з клітини води.
Однак коли кров стає менш концентрованою, ніж всередині еритроцитів (гіпотонічне середовище), проходження води буде легше відбуватися всередині клітини, роблячи її набрякають до лопання. Якщо кров досягає концентрації, що перевищує концентрацію еритроцитів (гіпертонічне середовище), то клітини крові в’януть, оскільки вони втрачають воду.

За тим же принципом збереження м'яса, збереження фруктівв компотах з цукерок, які зберігають їжу завдяки висока концентрація цукру у розчині.
Нижче наведено інші приклади, коли відбувається осмос:
- у підйомі соку в провідних судинах рослини;
- в гемодіаліз;
- при вибірковому проходженні поживних речовин у клітинах людського організму.
Щоб зрозуміти, як відбувається осмос у клітині тварини, рослинній клітині та інші біологічні проблеми, прочитайте: Осмос: що це таке і як він відбувається в клітині тварини і рослини.
Віктор Феррейра
Вчитель хімії
