THE стереоізомерія, також відомий як Космічна ізомерія, - це тип ізомерії, при якому його ізомери диференціюються за зв’язками між їх атомами, розташованими по-різному в просторі.
Існує два типи стереоізомерів, діастереомери та енантіомери. Діастереоізомери - це геометричні ізомери типу цис-транс, які не є дзеркальними зображеннями один одного, тоді як енантіомери - це оптичні ізомери, які є дзеркальними зображеннями один одного.
Трохи поговоримо про цис-транс-діастереоізомер, це відбувається лише в ненасичених або циклічних сполуках. Чому це не відбувається в насичених ланцюгових сполуках, тобто які мають лише одинарні зв’язки між вуглецями?
Може трапитися так, що ми заплутаємось, думаючи, що певні насичені сполуки є діастереоізомерами, хоча насправді вони представляють одну і ту ж сполуку. Наприклад, нижче ми маємо три просторові конформації атомів 1,2-дихлоретану:
H H H H H Кл
│ │ │ │ │ │
H — Ç — Ç — Н Н — Ç — Ç — ClH — Ç — Ç — H
│ │ │ │ │ │
Кл КлКл H Кл H
Це три діастереомери? Не. Власне,
три молекули - одна і та ж сполука. Що трапляється, так це те, що одинарні зв’язки або сигма (σ) між вуглецями можуть зазнавати обертання, що призводить до різного атомного розташування.Подивіться, як це відбувається на схемі нижче з етаном:

Ці сполуки, які насправді є одними і тими ж сполуками, не виконують геометричної цис-транс-ізомерії, але називаються конформаційні ізомери, оскільки вони відрізняються лише конформацією своїх атомів, спричиненою обертанням навколо єдиного зв’язку.
Одним із способів представити ці молекули для спрощення візуалізації обертання осі з'єднання є через Проекція Ньюмена, в якому вважається, ніби площина зору знаходилася точно на осі зв’язку між вуглецями, і вони представлені центральним колом. Див. Проекцію Ньюмана на етан:

Ми також можемо представити ці різні конформації через формула на мольбертах:
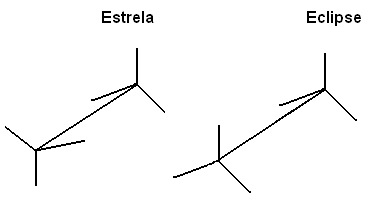
Це вільне обертання осі зчеплення більше не відбувається в ненасичених сполуках або в циклічних. Наприклад, уявімо, що ми будуємо просту модель, що представляє два вуглеці двома кульками з пінополістиролу, з'єднаними застряглою в них зубочисткою.
Коли у нас є одна зубочистка і ми тримаємо одну з кульок, інша може легко обертатися навколо власної осі, як це робиться при простому скріпленні.

Однак, якщо ми розмістимо ще одну зубочистку, що з’єднує дві сфери, ми не зможемо утримувати одну сферу і обертати іншу. Якщо ми зробимо це, зубочистки зламаються. Подібним чином, коли існує пі-зв'язок і сигма (подвійний зв'язок), виникає перешкода обертанню вуглецю.
Отже, у наведеному нижче випадку, коли ми маємо подвійний зв’язок між вуглецями, мова не йде про два конформаційні ізомери, тобто про дві конформації для однієї і тієї ж молекули; ми насправді маємо два цис-транс-діастереоізомери:
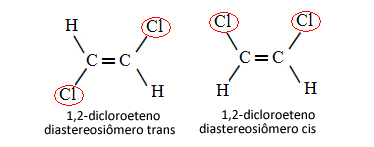
Детальніше про цей тип ізомерії дивіться в тексті Геометричні або цис-транс-ізомери.
Дженніфер Фогача
Закінчив хімію
Джерело: Бразильська школа - https://brasilescola.uol.com.br/quimica/isomeria-conformacional.htm

