Оборотні реакції зазвичай починаються з певної кількості реагентів. Коли починається пряма реакція, з часом ці реагенти витрачаються на формування продуктів, отже концентрація реагентів зменшується, тоді як концентрація продуктів збільшується. Потім також починається зворотна реакція, що також виробляє реагенти, поки швидкість розвитку (швидкість) прямої та зворотної реакцій не залишається незмінною, досягаючи т.зв. хімічний баланс.
В рівновазі існує константа рівноваги Kc, яка в основному виражається:
|
Kc = [продукція]коефіцієнт у збалансованому хімічному рівнянні [реактиви]коефіцієнт у збалансованому хімічному рівнянні |
Тобто, враховуючи таку загальну реакцію рівноваги:
a A + b B ↔ c C + d D
Оскільки малі літери є коефіцієнтами, а великі - речовинами, константа рівноваги цієї реакції буде:
Kc = [Ç]ç. [D]d
[THE]. [B]B
Детальніше про це можна побачити в тексті Константи рівноваги Kc та Kp. Цей текст також показує нам щось важливе: значення Kc можуть показати нам, чи є концентрація реагентів і концентрація продукти однакові або якщо один більший за інший, і, як наслідок, якщо хімічний баланс зміщений в деякому напрямку реакція.
Тож нам потрібно визначити значення Kc. Для цього слід пам’ятати, що ці розрахунки є експериментальними, тож давайте розглянемо деякі приклади реакцій та дані, отримані з них.
Щось, що дуже допомагає при виконанні цих обчислень, це написати таблицю, подібну до наведеної нижче, та виконати згадані в ній дії:

Таблиця для упорядкування даних, використовуваних для обчислення константи рівноваги
А тепер давайте займемося практикою:
Приклад 1: У закритому посуді ємністю 2 л при температурі 100 ° С знаходиться 20 моль N2О4. Починає відбуватися така оборотна реакція: N2О4 ↔ НІ2. Через деякий час було встановлено, що реакція досягла хімічної рівноваги і що 8 моль NO2 сформувався. Яке значення константи рівноваги Kc при температурі 100 ° C?
Дозвіл:
Скористаємося таблицею:

Таблиця, що використовується для розв’язання прикладу розрахунку константи рівноваги
Зверніть увагу, що в рядку, де були записані величини, які реагують і утворюються, ми знаємо, що було витрачено 4 молі N2О4, оскільки співвідношення становить 1: 2, і утворилося 8 моль NO2.
Тепер просто замініть значення, знайдені у виразі константи рівноваги Kc цієї реакції:
Kc = [БІЛЯ2]2
[N2О4]
Kc = (4 моль / л) 2
(8 моль / л)
Kc = 2 моль / л
Значення Kc є безрозмірним, воно не має одиниць, пов'язаних з якою-небудь величиною.
Тепер давайте розглянемо приклад, який також містить продукти з самого початку:
Приклад 2: У закритому контейнері, ємністю 5 л, при температурі Т знаходиться 2 моля газоподібного водню, 3 моля газоподібного йоду та 4 моля йодистого водню. Реакція вступає в хімічну рівновагу, при температурі Т, і виявляється, що в посудині знаходиться 1 моль газоподібного водню. Який графік відображає цю рівновагу і яке значення константи рівноваги Kc при температурі T?
Дозвіл:
Використання таблиці:
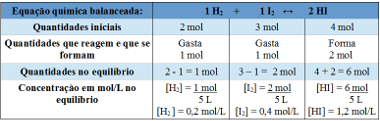
Таблиця, що використовується для визначення константи рівноваги
Графік, що відображає коливання концентрацій моль / л реагентів та продуктів до досягнення ними рівноваги, може бути отриманий за допомогою:

Графік хімічної рівноваги, що показує зміни концентрацій реагентів та продуктів
Тепер ми відкриваємо значення константи рівноваги:
Kc = __ [HI]2__
[H2 ]. [Я2]
Kc = (1,2)2
0,2. 0,4
Kc = 18
Дженніфер Фогача
Закінчив хімію
Джерело: Бразильська школа - https://brasilescola.uol.com.br/quimica/calculo-constante-equilibrio-kc.htm
