В міжмолекулярні сили це електростатичні сили притягання, функція яких полягає в об’єднанні молекул (молекулярних сполук), утриманні їх у твердому або рідкому стані. Вони надзвичайно важливі, оскільки визначають усі фізичні властивості (температура плавлення, температура кипіння, щільність та розчинність) речовин.
У цьому тексті ми вивчимо взаємозв’язок міжмолекулярних сил та температури кипіння речовин. Спочатку згадаємо три важливі типи міжмолекулярних сил, а саме:
♦ диполь дипол: сила, яка виникає в полярних молекулах. Оскільки ці молекули мають позитивний і негативний полюси, диполь-дипольна сила базується на притяганні між позитивним кінцем однієї молекули та негативним кінцем іншого. Приклади: HCl, HBr, SO2 та PH3
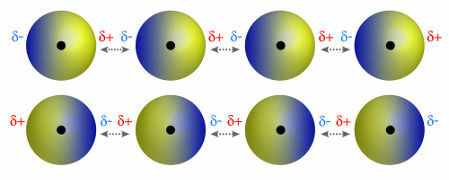
Молекули, які мають позитивний і негативний полюси, що притягують один одного
♦ Індукований дипол: - це міжмолекулярна сила, яка виникає лише в неполярних молекулах (вони не мають полюсів). Коли наближаються дві аполярні молекули, відбувається миттєва деформація їх хмар електронів, що викликає дисбаланс в електронах молекули, які розподіляються в для неї різні. У цей момент створюється миттєвий диполь, і молекула на мить має позитивний і негативний полюси, що викликає притягання. Приклади: CO
2, СН4 та ЧД3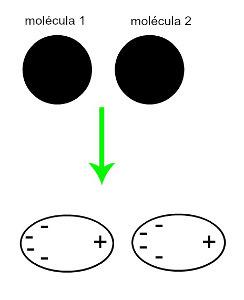
Наближення двох неполярних молекул породжує деформацію і, як наслідок, перерозподіл електронів, що утворює миттєві диполі
♦ Водневі зв’язки: це міжмолекулярна сила, що виникає в полярних молекулах, але лише у тих, у яких обов’язково є атоми водню, зв’язані безпосередньо з атомами фтору, кисню або азоту. Це можна вважати диполь-дипольною силою, але набагато більшої інтенсивності. Взаємодія завжди відбувається між воднем однієї молекули та іншим атомом (F, O, N) іншої молекули. Приклади: H2O, NH3 і HF
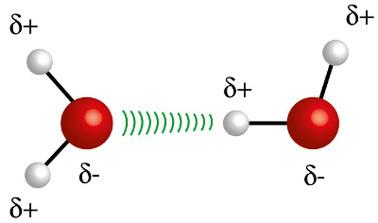
Атом водню (біла куля) однієї молекули взаємодіє з киснем (червона куля) іншої молекули води
Згадавши три міжмолекулярні сили, тепер ми можемо зв’язати їх з температурою кипіння речовин. це називається Точка кипіння температура, при якій молекули даної речовини перестають перебувати в рідкому стані (їх міжмолекулярні сили порушуються) і переходять у газоподібний стан. Цікавою деталлю є те, що міжмолекулярні сили та температура кипіння речовин мають дуже інтенсивний і прямий взаємозв'язок, оскільки чим інтенсивніша міжмолекулярна сила, тим вища температура кипіння. Порядок інтенсивності міжмолекулярних сил:
Індукований диполь
Таким чином, ми можемо зробити висновок, що молекули, що мають водневі зв’язки як силу взаємодії, мають вищі температури кипіння, ніж ті, що мають диполь-диполь тощо. У таблиці нижче наведено три речовини та їх значення температури кипіння:
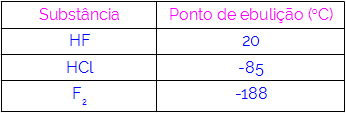
У таблиці ми спостерігаємо, що HF має вищу температуру кипіння, оскільки його молекули з'єднуються водневими зв'язками. Речовина F2 він має найнижчу температуру кипіння, оскільки його молекули притягуються індукованим диполем.
Мені Діого Лопес Діас
Джерело: Бразильська школа - https://brasilescola.uol.com.br/quimica/forcas-intermoleculares-ponto-ebulicao-das-substancias.htm
