Навчіться застосовувати перший закон термодинаміки в різних ситуаціях, вирішуйте вправи та перевіряйте свої знання за розв’язаними та поясненими вправами.
питання 1
Перший закон термодинаміки говорить, що:
а) Енергію неможливо створити або знищити, але її можна перетворити з однієї форми в іншу.
б) Енергія завжди зберігається, але її неможливо перетворити з однієї форми в іншу.
в) Енергію можна створити або знищити, але її неможливо перетворити з однієї форми в іншу.
г) Енергію неможливо зберегти, але її можна перетворити з однієї форми в іншу.
Перший закон термодинаміки — це принцип збереження енергії, тобто в системі закрита, кількість енергії залишається постійною і може лише перетворюватися з однієї форми в іншу. інший.
питання 2
Припустимо замкнуту систему, яка отримує 100 Дж теплоти при виконанні роботи 50 Дж. Яка зміна внутрішньої енергії системи?
а) -50 Дж
б) 0 Дж
в) 50 Дж
г) 100 Дж
д) 150 Дж
Перевірка знаків:
Отримане тепло позитивне Q > 0.
Виконана робота додатна W > 0.
Відповідно до першого закону маємо:
питання 3
Ідеальна газова система обмінюється із зовнішнім середовищем 500 джоулями тепла. Вважаючи цей процес ізометричним охолодженням, визначити роботу і внутрішню енергію відповідно.
а) 500 Дж і 0 Дж
б) - 500 і 0 Дж
в) 0 Дж і 500 Дж
г) 0 Дж і - 500 Дж
д) -500 Дж і 500 Дж
Оскільки процес є ізометричним, об’єм не змінюється, тому робота дорівнює нулю.
Відповідно до першого закону термодинаміки:
Оскільки це охолодження, система втрачає тепло, тому:
питання 4
8 моль ідеального газу в системі поршень-циліндр стискаються при виконанні роботи 1000 Дж. Під час процесу у зовнішнє середовище втрачається 400 Дж тепла. Його внутрішня енергія і зміна його температури відповідно дорівнюють
Дано: R = 8,31 Дж/моль. К
а) - 1400 Дж і приблизний розкид 6 К
б) 600 Дж і наближена варіація 6 К
в) 600 Дж і наближена варіація 14 К
г) - 1400 Дж і приблизний розкид 14 К
внутрішня енергія
Оскільки система отримує роботу, її знак негативний, як і тепло, яке при цьому втрачається.
Перший закон термодинаміки:
Підставляючи значення, отримуємо:
R = 8,31 Дж/моль K
температура
За законом Джоуля маємо:
питання 5
Ідеальний газ стискається, виконуючи роботу 500 Дж. Наприкінці цього перетворення внутрішня енергія системи змінилася на 200 Дж менше, ніж на початку. Кількість теплоти, яку обміняв газ, становила
а) - 700 Дж
б) - 300 Дж
в) 300 Дж
г) 0J
д) 700 Дж
Оскільки отримана робота, тобто стійка робота, її знак від’ємний.
Підставляючи значення в рівняння першого закону термодинаміки:
питання 6
(CEDERJ 2021) На етапі циклу, що виконується ідеальним газом у кондиціонері, тиск газу підвищується, зберігаючи його об’єм незмінним. На цьому етапі циклу робота W, виконана газом, кількість тепла Q, що поглинається ним, і зміна ΔT його температури дорівнюють відповідно:
а) W < 0, Q < 0 і ΔT < 0
b) W = 0, Q > 0 і ΔT > 0
в) W = 0, Q = 0 і ΔT = 0
d) W > 0, Q > 0 і ΔT > 0
дані:
Тиск Р зростає;
Гучність залишається постійною;
Робота
Оскільки об’єм постійний, то робота W дорівнює нулю.
Перший закон термодинаміки виглядає так:
Оскільки тепло позитивне, зміна внутрішньої енергії також буде позитивною.
Тепло
Оскільки тепло поглинається, воно позитивне.
температура
За законом про газ:
Де,
n – кількість молей
R – універсальна газова стала
Таким чином, температура залежить тільки від тиску, оскільки об'єм постійний, будучи позитивним.
питання 7
(UNICENTRO 2018) Відповідно до Першого закону термодинаміки, зміна внутрішньої енергії системи, ΔU, становить визначається різницею між теплообміном із зовнішнім середовищем, Q, і роботою, W, виконаною в процесі термодинамічний. Враховуючи цю інформацію, якщо одноатомний газ розширюється так, щоб завжди залишатися при тій самій температурі, це перетворення можна представити рівнянням
а) ΔU + W = 0
б) ΔU − W =0
в) Q − W = 0
г) Q + ΔU = 0
Ізотермічний процес відбувається без зміни температури.
Енергія пов’язана з температурою:
Де n – кількість молей, а R – універсальна газова стала. Оскільки n і R постійні, існує лише зміна температури і
Перший закон термодинаміки виглядає так:
питання 8
(URCA 2016) Відповідно до першого закону термодинаміки, якщо під час ізотермічного процесу, якому зазнає ідеальний газ фіксованої маси, газ виділяється кількість теплоти, величина якої становить 50 кал, тоді зміна внутрішньої енергії та робота, виконана газом у цьому процесі, відповідно:
а) 0 і 50 кал.
б) 50 кал і 0.
в) 0 і 0.
г) 50 кал і -50 кал.
д) 0 і -50 кал.
Зміна внутрішньої енергії безпосередньо пов’язана зі зміною температури. Оскільки процес є ізотермічним, то температура не змінюється .
З першого закону термодинаміки:
Оскільки при цьому виділяється тепло, то його знак негативний.
питання 9
(UFRN 2012) Біомаса є одним із основних джерел відновлюваної енергії, тому машини, які використовують її як паливо для виробництва електроенергії, важливі з екологічної точки зору. Дуже поширеним прикладом є використання біомаси для роботи парової турбіни. На малюнку збоку схематично зображено спрощену термоелектростанцію.
У цій термоелектростанції спалювання біомаси в печі виробляє тепло, яке нагріває воду в котлі та генерує пару під високим тиском. Пара, у свою чергу, по трубах направляється до турбіни, яка під його дією починає обертати свої лопаті.
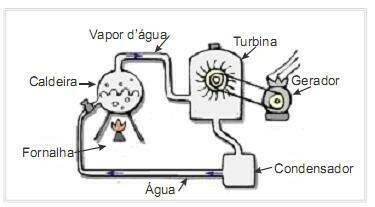
Втрати тепла через різницю температур між частинами цієї теплової машини та навколишнім середовищем вважати незначними. У цьому контексті зміна внутрішньої енергії котлової води
а) більше, ніж сума тепла, що надходить до нього в результаті спалювання біомаси, і роботи, виконаної на турбіні.
б) дорівнює сумі тепла, що підводиться до нього при спалюванні біомаси з роботою, що виконується на турбіні.
в) дорівнює різниці між теплом, що підводиться до нього при спалюванні біомаси, і роботою, виконаною на турбіні.
г) більше, ніж різниця між теплотою, що підводиться до нього при спалюванні біомаси, і роботою, виконаною на турбіні.
Вода в котлі отримує енергію у вигляді тепла від згоряння палива та вивільняє енергію у вигляді роботи, що виконується на турбіні.
питання 10
(UECE 2021) Щодо властивостей газів, зверніть увагу на такі твердження:
i. Для ідеального газу внутрішня енергія є функцією лише тиску.
II. Теплота, яку поглинає газ при зміні свого стану, не залежить від процесу.
III. Внутрішня енергія ідеального газу є функцією лише температури і не залежить від процесу.
IV. При ізотермічному розширенні ідеального газу виконана ним робота дорівнює поглиненій теплоті.
Правильно те, що зазначено лише в
а) І і ІІ.
б) III і IV.
в) I і IV.
г) II і III.
III. ПРАВИЛЬНО. Внутрішня енергія ідеального газу є функцією лише температури і не залежить від процесу.
Зміна внутрішньої енергії безпосередньо пов’язана зі зміною температури.
Де n — кількість молей, а R — постійна ідеального газу, будучи константою, внутрішню енергію газу визначає лише температура.
IV. ПРАВИЛЬНО. При ізотермічному розширенні ідеального газу виконана ним робота дорівнює поглиненій теплоті.
Оскільки він ізотермічний, температура не змінюється, тому зміна внутрішньої енергії дорівнює нулю. За першим законом термодинаміки:
Дізнайтеся більше з:
- Перший закон термодинаміки
- Термодинаміка: закони, поняття, формули та вправи
- Вправи з термодинаміки
- газове право
ASTH, Рафаель. Вправи з першого закону термодинаміки.Все має значення, [n.d.]. Доступний у: https://www.todamateria.com.br/exercicios-da-primeira-lei-da-termodinamica/. Доступ за адресою:
Дивіться теж
- Вправи з термодинаміки
- Термодинаміка
- адіабатичне перетворення
- Вправи з термохімії
- Перший закон термодинаміки
- Природничі науки та їх технології: Енем
- Термальна енергія
- Другий закон термодинаміки
