Карбонати - це неорганічні сполуки, утворені іонним зв’язком металу або напівметалу з карбонатним аніоном, CO32-.
Вуглець чотиривалентний, тобто він має чотири електрони у валентній оболонці, і він може створити чотири ковалентні зв’язки, щоб бути стабільним, в той час як кисень є двовалентним, маючи шість електронів у валентній оболонці і будуючи два зв’язки, щоб бути стабільним електрони. Таким чином, існує сильна тенденція вуглецю зв’язуватися з двома атомами кисню, які є стабільними (O ═ C ═ O → CO2).
Але інший кисень може поєднуватися з вуглецем, оскільки співвідношення іонних радіусів призводить до координаційного числа, рівного 3, утворюючи структуру трикутний, в якому вуглець знаходиться в центрі, утворюючи подвійний зв’язок з одним з атомів кисню і два одинарних зв’язки з двома іншими кисню. Результатом є два надлишкових електрони, оскільки ці два кисню не є стабільними, і потрібно отримувати по одному електрону кожен:
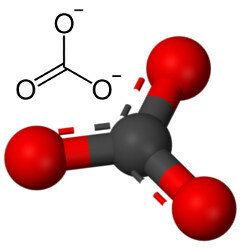
Карбонатний аніон утворюється ковалентними зв’язками, але його сполуками, які є неорганічними солями та мінералами відомі як карбонати, є іонними, оскільки цей радикал отримує два електрони від якогось металу або напівметалу, утворюючи а іонний зв’язок.
Ці сполуки не розчиняються у воді, за винятком карбонату амонію ((NH4)2CO3) та карбонати, утворені лужними металами (елементи сімейства 1: Li, Na, K, Rb, Cs та Fr). Майже всі це білі тверді речовини, як показано на зображенні нижче:

Два найпоширеніші та найважливіші повсякденні приклади карбонатів - це карбонат натрію (Na2CO3) і карбонат кальцію (CaCO3). У першому випадку натрій належить до сімейства 1, що має електрон у валентній оболонці і прагне втратити цей електрон, щоб стати стабільним. Оскільки карбонатний аніон повинен отримувати два електрони, він зв'язується з двома атомами натрію:

Сода кальцинована більше відома як сода або сода, використовується у виробництві мила, барвників, ліків, паперів та для лікування води в басейні. Але основним його застосуванням є карбонат кальцію та пісок у виробництві скла.
Кальцій - це родина 2, яка має тенденцію втрачати два електрони. Таким чином, атом кальцію зв'язується з карбонатним радикалом:

Карбонат кальцію присутній у вапняку та мармурі. В сталактити та сталагміти що існують у печерах, складаються з цього карбонату; черепашки, коралові рифи та яєчна шкаралупа теж. Побіляючи стіни, стовбури дерев та інші місця, ми використовуємо гідроксид кальцію (Ca (OH)2), який з часом реагує з атмосферним вуглекислим газом, утворюючи карбонат кальцію.

Карбонати дуже поширені на земній поверхні, як у випадку з мінералами. Його кристалічний ретикулум може переставити себе у просторі двома способами: орторомбічним (як у випадку з мінералом арагонітом, показаним вище разом із формулою карбонату кальцію) та ромбоедричний або тригональний, як у випадку з кальцитом (іншим мінералом, що складається з карбонату кальцію).
Карбонати реагують у присутності кислот, виділяючи СО2, що легко помітити через шипучість.
Дженніфер Фогача
Закінчив хімію
