THE оганессон, символ Ог, атомний номер 118 є хімічним елементом з найвищим атомним номером у Періодичній системі. Його неможливо знайти в природі, і його виробництво є штучним, тому вважається синтетичним елементом. Незважаючи на це, його виробництво дуже складне, і він вважається дуже рідкісним елементом, який був синтезований дуже мало разів.
Незважаючи на те, що в одній групі з благородні гази, оганессон не має багато характеристик, які відносяться до цих елементів, згідно з розрахунками математики демонструють, як наслідок релятивістських ефектів, які страждають надважкі елементи.
Елемент 118 вперше був синтезований у 2002 році шляхом реакції іонів 48Ca з атомами 249Побачити Його назва — данина поваги російському вченому Юрію Оганесяну, одному з найбільш шанованих і визнаних в області надважких елементів.
Дивіться також: Резерфордій — синтетичний хімічний елемент, названий на честь вченого Ернеста Резерфорда
Резюме про оганессон
Оганессон – синтетичний хімічний елемент, що відноситься до 18 групи Періодична таблиця.
Вперше він був синтезований у 2002 році у спільній роботі російських та американських вчених.
Він становить групу елементів, нещодавно включених до Періодичної таблиці в 2016 році.
Це дуже рідкісний елемент, його синтезували дуже мало разів.
Їх дослідження ще зовсім недавно, а основні властивості все ще визначаються розрахунками та математичними моделями.
Попередні теоретичні випробування показують, що, незважаючи на приналежність до групи благородних газів, деякі властивості віддаляють Og від інших елементів.
Продукція оганессону відбувається шляхом Ядерний синтез, з використанням іонів 48Ca та атоми 249Побачити
Його назва — данина поваги російському вченому Юрію Оганесяну, одному з найважливіших у галузі вивчення надважких елементів.
Не зупиняйся зараз... Після оголошення буде більше ;)
властивості оганессона
Символ: о
Атомний номер: 118.
Атомна маса: 294 ц.у. (неофіційний Юпак).
Електронна конфігурація: [Rn] 7 с2 5f14 6d10 7 р6.
Найбільш стабільний ізотоп: 294Og (період напіввиведення 0,69 мілісекунди, який можна збільшити на 0,64 мілісекунди або зменшити на 0,22 мілісекунди).
Хімічна серія: група 18, надважкі елементи, благородні гази.
Характеристика оганессона
Оганессон - це найвищий елемент з атомним номером (118), оголошений досі Міжнародним союзом чистої та прикладної хімії (IUPAC). Незважаючи на те, що вперше він був виготовлений у 2002 р. про нього мало що відомо. Ще багато припущень, оскільки цей елемент не зустрічається в природі. Його виробництво здійснюється в лабораторії, що налаштовує його як синтетичний елемент.
Крім того, ваш півжиття менше мілісекунди (10-3 другий) — пам’ятаючи, що період напіврозпаду — це час, необхідний для зменшення кількості вдвічі. Тому властивості, які обумовлюються для цього елемента, є не що інше, як результати теоретичні розрахунки на основі математичних моделей, оскільки в області періодичної системи, в якій вона знаходить релятивістські ефекти (розбіжність між очікуваними та спостережуваними ефектами в результаті відносності) є значними.
Релятивістські ефекти відводять Ога від того, що від нього очікували. Елемент, наприклад, не має схожої поведінки з благородними газами. Розрахунки показують, що оганессон буде твердим при кімнатній температурі з температурою плавлення в діапазоні 325 ± 15 K (близько 52 °C) і температурі кипіння в діапазоні 450 ± 10 K (близько 177 °C).
Відомо також, що Og може бути більш реакційноздатним, ніж інші благородні гази, оскільки релятивістські ефекти дозволяють йому легше втрачати електрони p-підрівня. Іншим моментом розбіжності щодо благородних газів є те, що оганессон є а напівпровідник, а інші є ізоляторами.
Читайте також: Водень — хімічний елемент, який має найменший атомний номер у періодичній системі
Отримання оганессона
Як і інші надважкі елементи, оганессон отримують за допомогою техніки, яка називається гарячий розплав, де іони ізотопу 48Са, який зустрічається в природі, але доступний дуже мало, реагує з набагато більш важкими ізотопами, утворюючи надважкі елементи.
Og є настільки рідкісним і важкодоступним елементом, який за десять років лише чотири атоми почало випускатися. В основному, виробництво 294Og, єдиний відомий ізотоп, виникає шляхом іонного бомбардування 48Ca до ядра 249Пор., з виділенням 3 нейтронів.
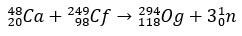
З кількома мілісекундами періоду напіврозпаду Og було ідентифіковано за закономірністю розпаду, щось дуже поширене для надважких елементів. У цьому випадку відбулися 3 альфа-розпади, внаслідок чого елемент 118 перетворився на коперніцій Cn, який, нарешті, зазнав спонтанного поділу.
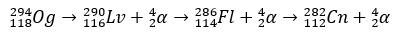
історія оганессона
Перший синтез оганессону відбувся в 2002 році., в місті Лівермор, Каліфорнія, США, в Ліверморській національній лабораторії Лоуренса, де група американських учених співпрацювала з російськими дослідниками знаменитого Об’єднаного інституту ядерних досліджень (ОІЯР), очолюваного російським ученим Юрієм Оганесяном.
За десять років після першого синтезу було синтезовано лише чотири атоми оганессону через рідкість і складність параметрів реакції. Проте четвертий і останній атом зробив неймовірне відкриття.
Вчені намагалися синтезувати елемент 117 за допомогою реакції 48Ca з 249Bk, однак було помічено, що 28% мішені беркелію зазнало β-розпаду, перетворюючись на 249Cf і, таким чином, генеруючий елемент 118. Примітно, що назва елемента 118 вшановує російського вченого Юрія Оганесяна, вшанування того, що для живих хіміків в історії хімії було лише двічі, першим – Гленну Сіборгу, з сіборгіум.
Розв'язані вправи на оганессон
питання 1
Оганесон, елемент з атомним номером 118 і символом Og, був поміщений в сьомий період періодичної таблиці, в групу благородних газів. У результаті багато припущень про те, чи буде такий елемент мати велику стабільність, характеристику, відому іншим елементам цієї групи. Виділення Ог у групу 18 обумовлено:
А) цей елемент дуже стійкий.
Б) цей елемент має у своїй валентній оболонці вісім електронів.
C) цей елемент, очевидно, є газом кімнатної температури.
Г) цей елемент має ті самі хімічні властивості, що й інші благородні гази.
Д) цей елемент має високу енергію іонізації.
Роздільна здатність:
Альтернатива Б
Виділення Og відбувається виключно і виключно за його рахунок електронний розподіл. Той факт, що він має вісім електронів валентний шар, 7с2 7 р6, ставить його в це положення. Дослідження з цим елементом ще є попередніми, але вже припускається, що, наприклад, через математичні результати, Og не є газом кімнатної температури. Ще один момент, який слід підкреслити, полягає в тому, що Og взагалі не стабільний, навіть не існує в природі.
питання 2
Великі труднощі з отриманням елемента 118 породжують ідею, що вчені були в справжній одіссеї, щоб мати можливість його виявити. Не дивно, що після десяти років першого синтезу оганессон був синтезований лише три рази. І поки відомий лише один ізотоп, 294о Скільки нейтронів має відомий ізотоп оганесона?
А) 294.
Б) 118.
в) 176.
Г) 412.
E) 166.
Роздільна здатність:
Альтернатива C
Кількість нейтронів Og можна розрахувати так:
A = Z + n
А – кількість макарони атомний, Z – кількість протонів (або атомний номер), а n – кількість нейтронів. Підставляючи значення, маємо:
294 = 118 + н
n = 294 - 118
n = 176
Стефано Араухо Новаїс
Вчитель хімії
