THE ентальпія – термодинамічна функція, за допомогою якої обчислює теплоту, що бере участь в ізобарних процесах, тобто які перебувають під постійним тиском. Його розвиток відбувся незабаром після падіння теорії калорійності, з просуванням термодинаміка між 1840 і 1850 роками.
Ентальпія для щоumica, не має великого значення, якщо воно працює як абсолютне та ізольоване значення, але воно має при розгляді зміна його значення в хімічному процесі. Існує кілька способів обчислення зміни ентальпії процесу, основними з яких є енергії утворення, зв’язування, а також за допомогою тампривіт від Гесс.
Читайте також: Що таке вільна енергія Гіббса?
Резюме по ентальпії
Ентальпія — це термодинамічний інструмент для розрахунку теплоти, що бере участь у процесах, що відбуваються при постійному тиску.
Його визначив американський фізик Джозая В. Гіббса, в контексті падіння теорії калорійності.
У хімії ми завжди використовуємо зміну ентальпії, представлене як ΔH.
Хімічні реакції, які поглинають тепло, називаються ендотермічними і мають ΔH > 0.
Хімічні реакції, які виділяють тепло, називаються екзотермічними і мають ΔH < 0.
Відеоурок з ентальпії
Що таке ентальпія?
Спочатку ентальпія, яка завжди позначається H, була визначений американським фізиком Джозаєю Віллардом Гіббсом, яку він назвав функцією тепла при постійному тиску, оскільки, за його словами:
«[...] зменшення функції означає, у всіх випадках, коли тиск не змінюється, тепло, яке віддає система».
Отже, з роботи Гіббса ми можемо зрозуміти ентальпію як термодинамічну функцію якої варіація чисельно дорівнює кількості теплообміну в системі, до тиск постійний. Це означає, що в ізобарних процесах (як і в більшості хімічних процесів) знання Розрахувати зміну функції ентальпії, можна дізнатися величину теплообміну між системою і околиці.

Така кореляція з теплом викликає багато студентів помилково думають, що ентальпія є синонімом тепла або щось на кшталт енергетичного вмісту, вмісту тепла, виділеного тепла та поглиненого тепла тощо.
Ентальпія виникла в контексті краху калорійної теорії, яка розглядала тепло як невичерпну матеріальну речовину, яка переносилася від більш теплих тіл до більш холодних. Таким чином, виникла потреба мати новий інструмент для розрахунку тепла. Отже, рішення полягало у використанні величин, які вже мали визначені термодинамічні рівняння, наприклад ентальпія.
Читайте також: Як обчислити зміну ентальпії розчину?
зміна ентальпії
Оскільки ентальпія є інструментом, який використовується для обчислення теплообміну в хімічному процесі, немає сенсу використовувати її як абсолютне ізольоване число, але враховуючи його варіацію, тобто на практиці, ми повинні лише оцінити, наскільки чисельно змінилася ентальпія під час хімічного процесу, оскільки термодинаміка запевняє нас, що її варіація є чисельно дорівнює теплоті, що виділяється або поглинається в процесі.
Строго кажучи, ми можемо визначити зміну ентальпії як:
ΔH = HЗаключний - Хпочатковий
Як і в хімічних процесах, кінцевим етапом можна вважати продукти, а початковим — реагентами. Також часто можна побачити визначення варіації ентальпії як:
ΔH = Hпродуктів - Хреагенти
З практичної та інтерпретаційної точки зору, якщо зміна ентальпії додатна (ΔH> 0), ми говоримо, що хімічна реакція є ендотермічний, тобто відбувається поглинання тепла протягом усього процесу. Вже якщо зміна ентальпії негативна (ΔH< 0), ми говоримо, що хімічна реакція є екзотермічний, тобто тепло виділяється протягом усього процесу.
Зміна ентальпії в багатьох випадках спостерігається на графіках, як показано в наступних прикладах.
Приклад 1:
Таблиця ендотермічних реакцій
На графіках ентальпії ендотермічних реакцій можна побачити, що кількість ентальпії продуктів більша, ніж ентальпії реагентів, що вказує на те, що зміна вздовж реакції є позитивною. Таким чином, якщо ΔH > 0, можна сказати, що хімічний процес відбувався з поглинанням тепла.
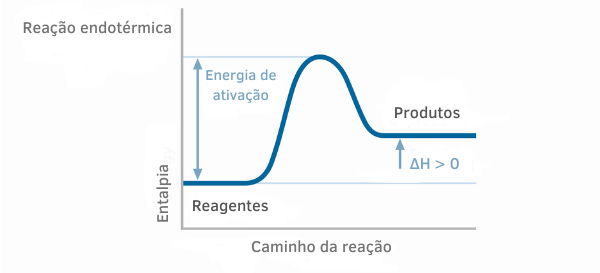
Приклад 2:
Таблиця екзотермічних реакцій:
На графіках ентальпії для екзотермічних реакцій можна побачити, що кількість ентальпії продуктів менша, ніж ентальпії реагентів, що вказує на те, що зміна вздовж реакції є негативною. Таким чином, будучи ΔH < 0, можна сказати, що хімічний процес відбувався з виділенням тепла.
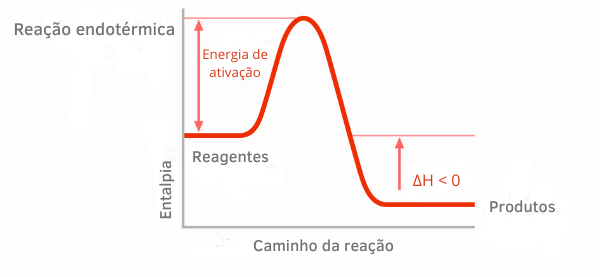
Детальніше про ці класифікації хімічних реакцій читайте в тексті: ДЛЯендотермічні та екзотермічні процеси.
Види ентальпії
ентальпія утворення
THE ентальпія утворення é розраховано на основі утворення хімічних реакцій, які являють собою реакції, в яких із їх найстійкіших простих речовин утворюється один моль складних речовин при кімнатній температурі та тиску в 1 атмосфері.
Х2(g) + ½ O2 (g) → H2O (l) H°f = -286 кДж/моль
Великою перевагою ентальпії утворення є те, що прості речовини, які є більш стабільними при кімнатній температурі та 1 атмосфері тиску, мають ентальпію, рівну нулю. Це не означає, що вони насправді нульові, але для спрощення та кращої класифікації вони розглядаються так.
буття Х = Hпродуктів - Хреагенти, якщо врахувати, то, що Хреагенти = 0, можна сказати, що спостережуване значення ΔH пов’язане лише з продуктами, які в цих випадках завжди є одним моль сполуки. Тому ми наведемо це значення як стандартну зміну ентальпії утворення води, представлену як ΔH°f.
Саме з цією методологією кілька речовин мали свої варіації стандартна ентальпія формувальні таблиці, як ми бачимо нижче.
Речовина |
Ентальпія утворення (ΔH°f) в кДж/моль |
CO2 (g) |
-393,4 |
CaO(s) |
-634,9 |
HI(g) |
+25,9 |
НІ (г) |
+90,1 |
ентальпія зв'язування
Ентальпія зв’язування служить для вказівки на кількість енергії, яка бере участь у розриві або утворенні даної родимки. хімічний зв'язок.
Зрозуміло, що, щоб розірвати хімічний зв'язок, необхідно поглинати тепло, так що атоми зв'язку збільшують їх внутрішня енергія і, отже, збільшити вашу кінетичну енергію. з більшим кінетична енергія, атоми вібрують інтенсивніше, викликаючи розрив зв’язків. Таким чином, кожен розрив зв’язку є ендотермічним процесом.
Інакше, щоб утворити хімічний зв’язок, атоми втрачають свободу руху, і їм необхідно зменшити ступінь руху, зменшуючи свою кінетичну енергію. Тоді запасна енергія виділяється у вигляді тепла. таким чином, все утворення зв’язків є екзотермічним процесом.
У таблиці нижче показано значення енергій, пов’язаних з кожним хімічним зв’язком.
Підключення |
Енергія зв'язку (кДж/моль) |
C-H |
412,9 |
C-C |
347,8 |
O═O |
497,8 |
F-F |
154,6 |
НЕМАЄ |
943,8 |
Зверніть увагу, що у значеннях немає знаків, оскільки вони мають модуль. Це пов’язано з тим, що сигнал має бути призначений вами залежно від того, зірвано чи сформовано посилання.
Ентальпія горіння
THE ентальпія горіння служить для позначення кількість теплоти, що виділяється при згорянні одного моля речовини. Слід зазначити, що кожна реакція горіння є екзотермічною, оскільки кожне горіння виділяє тепло.
CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2ΔH°Ç = -889,5 кДж/моль
У таблиці нижче показано значення ентальпії горіння деяких хімічних речовин.
Речовина |
Ентальпія горіння (ΔH°Ç) в кДж/моль |
Етанол - C2Х5О (1) |
-1368 |
Бензол - C6Х6 (1) |
-3268 |
Октан - C8Х18 (1) |
-5471 |
Глюкоза - C6Х12О6 (s) |
-2808 |
Ентальпія зміни агрегатного стану
Кожна зміна агрегатного стану пов’язана з теплообміном. Тому, ентальпія зміни агрегатного стану служить для позначення кількість тепла, що бере участь у процесах зміни агрегатного стану.
Наприклад, ми маємо випаровування води:
Х2O (1) → H2O (г) ΔH = +44 кДж/моль
При плавленні води маємо:
Х2O(s) → H2O (л) ΔH = +7,3 кДж/моль
Значення ентальпії є симетричними для обернених процесів, що означає, що, наприклад, зміна ентальпії при зрідженні води становить -44 кДж/моль, а при її затвердінні вона дорівнює -7,3 кДж/моль.
Читайте також: Що таке ентропія?
Розв’язані вправи на ентальпію
Питання 1 - (UERJ 2018) Забруднювальна здатність вуглеводню, що використовується як паливо, визначається співвідношенням між вивільненою енергією та кількістю CO2 утворюється при його повному згорянні. Чим вище коефіцієнт, тим менше забруднювальна здатність. У таблиці нижче наведено стандартну ентальпію згоряння чотирьох вуглеводнів.

З таблиці вуглеводень з найменшою забруднювальною здатністю:
Октан
гексан
Бензол
пентан
Резолюція
Альтернатива Д
Питання вказує на те, що забруднювальна здатність визначається як відношення (частка) між виділяється енергією та кількістю CO2 утворюється при його повному згорянні. Чим більший причина, тим нижча забруднювальна здатність, тобто більше енергії виділяється на моль СО2 згенеровано.
Реакції повного горіння Вуглеводні цитуються:
Октан: Ç8Х18 +25/2 О2 → 8 CO2 +9 годин2Причина: 5440/8 = 680
гексан: Ç6Х14 +19/2 О2 → 6 CO2 + 7 годин2Причина: 4140/6 = 690
Бензол: Ç6Х6 + 15/2 О2 → 6 CO2 + 3 H2Причина: 3270/6 = 545
пентан: Ç5Х12 + 8 О2 → 5 CO2 + 6 H2Причина: 3510/5 = 702
Таким чином, можна зробити висновок, що пентан є вуглеводнем з найменшою забруднювальною здатністю.
Питання 2 - (Enem 2015) Використання лісових відходів з кожним днем стає все більш привабливим, оскільки вони є відновлюваним джерелом енергії. На малюнку зображено спалювання біомасла, видобутого з деревних відходів, де ΔH1 зміна ентальпії внаслідок спалювання 1 г цього біомасла, що призводить до утворення вуглекислого газу та рідкої води, а також ΔH2 зміна ентальпії, яка бере участь у перетворенні 1 г води з газоподібного стану в рідкий.

Зміна ентальпії, у кДж, для спалювання 5 г цього біомасла, що призводить до CO2 (газоподібний) і H2(газоподібний) це:
А) -106
Б) -94
В) -82
Г) -21,2
E) -16,4
Резолюція
Альтернатива C
З представленого графіка маємо ΔH1 як зміна ентальпії спалювання біонафти з утворенням CO2 (g) і H2O (1) і ΔH2 як зміна ентальпії зрідження води, оскільки CO2 залишається газоподібним і тільки агрегатний стан Вода змінюється (з газоподібного на рідкий).
Вправа вимагає зміни ентальпії спалювання 5 г біомасла, що призводить до утворення CO2 (газоподібний) і H2O (газоподібний). З діаграми цю зміну ентальпії можна визначити як ΔH = ΔH1 – Х2. Таким чином, значення ΔH буде дорівнює -16,4 кДж/г. Ця зміна, як ми бачимо в одиниці, стосується КОЖНОГО грама біомасла. Для 5 грам ми повинні зробити пропорція:
1 г біомасла -16,4 кДж
5 г біомасла х
1. х = 5. (-16,4)
х = -82 кДж
Тоді ми можемо позначити альтернативу C.
Стефано Араужо Новаїс
Вчитель хімії

