Окислення — це назва процесу втрати електронів атомом, групою чи іонними елементами під час а хімічна реакція. Його визначають за збільшенням в NOX (число окислення) виду або атома при порівнянні реагенту та продукту.
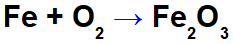
Рівняння окислення заліза.
У наведеному вище рівнянні, наприклад, ми можемо вказати NOX кожного з учасників:
Залізо-реагент (Fe): має NOX 0 як a проста речовина;
Кисень у реагенті (O): має NOX 0, оскільки це проста речовина;
Кисень у продукті: він містить NOX -2, оскільки він не пов’язаний з лужним металом, лужноземельні або утворення водню перекиси або супероксиди;
Залізо в продукті: воно має NOX +3, тому що сума NOX заліза, помножена на 2 (кількість атомів) + NOX кисню, помножена на 3, повинна привести до 0, оскільки це складна речовина:
x.2 + 3.(-2) = 0
2x - 6 = 0
2x = +6
х = + 6
2
х = +3
Порівнюючи NOX заліза-реагенту (0) з продуктом (+3), ми спостерігали збільшення, тобто він пройшов процес окислення. Варто відзначити, що виникнення о окислення воно завжди супроводжується явищем відновлення (що означає посилення електронів), що визначається зменшенням NOx, як це відбувається з киснем у прикладі.
Читайте також:Визначення ступеня окислення (NOX)
Приклади ситуацій, в яких відбувається окислення:
1. Горіння

Горіння матеріалу також свідчить про окислення.
Горіння - це кожна хімічна реакція, що відбувається в присутності a паливо будь-який і окислювальний газ кисень (O2), що призводить до вироблення тепла і світла. У кожному випадку відбувається реакція горіння окислення.
2. Деякі органічні реакції
У кожній органічній реакції, що протікає в присутності перерахованих нижче засобів, відбувається процес окислення:
Калію дихромат (К2кр2О7) або перманганат калію (KMnO4);
Наявність сильної кислоти або сильної основи;
Газовий озон (О3) у присутності металевого цинку (Zn) і води (H2О).
3. Батарейки або батарейки

Акумулятори - це пристрої, в яких завжди відбувається окислення.
Стеки або батареї – це електрохімічні пристрої, які зберігають хімічні речовини. Одна з цих речовин буде піддаватися окисленню, а інша відновлюватися, в результаті чого утворюється електричний струм.
4. Електроліз
Електроліз це хімічний процес, у якому водний розчин, що містить сіль, піддається дії електричного струму, який в кінцевому підсумку сприяє окисненню аніонів, присутніх у цих матеріалах. У всьому електролізі є окислення.
Від мене Діого Лопес Діас
Джерело: Бразильська школа - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-oxidacao.htm

