Вуглеводні - це сполуки, що утворюються лише вуглецем та воднем із загальною формулою: CхHр.
Це велика кількість речовин, найбільш відомі з яких є складовими нафти та природного газу.
Основу вуглеводню складають вуглець і, в свою чергу, атоми водню зв'язуються через ковалентний зв'язок.
Вони широко використовуються в хімічній промисловості, маючи важливе значення у виробництві нафтових похідних: палива, полімерів, парафінів та інших.
Властивості вуглеводнів
| молекулярна взаємодія | Вони є практично неполярними сполуками, і їх молекули з'єднані індукованим диполем. |
|---|---|
| Температура плавлення і кипіння | Вони низькі порівняно з полярними сполуками. |
| агрегаційні стани |
|
| Щільність | Вони мають меншу щільність, ніж вода. |
| Розчинність | Вони не розчиняються у воді і розчиняються в неполярних речовинах. |
| Реактивність |
|
Класифікація вуглеводнів
Що стосується форми головного вуглецевого ланцюга, то вуглеводні класифікуються на:
аліфатичні вуглеводні
Утворені відкритими або ациклічними вуглецевими ланцюгами, які мають кінцеві вуглеці.
- алкани
- алкени
- Алкіни
- Алкадієни
Приклад:
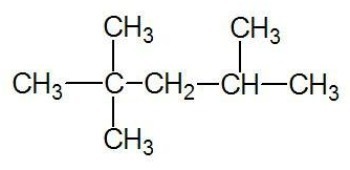
Дивіться теж: вуглецеві ланцюги
Циклічні вуглеводні
Утворені замкнутими або циклічними вуглецевими ланцюгами, які не мають кінцевих вуглеців.
- Циклани
- Цикли
- велосипедистів
- Ароматичні
Приклади:
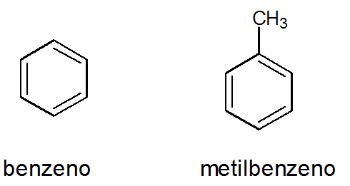
Дивіться теж: бензол
Що стосується зв’язків вуглецевих ланцюгів, будь то одинарні, подвійні або потрійні:
Насичені вуглеводні
Сполуки утворюються одинарними зв’язками між атомами вуглецю та водню.
- алкани
- Циклани
Приклад:
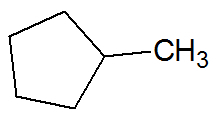
ненасичені вуглеводні
Утворені сполуки мають подвійні або потрійні зв’язки між атомами вуглецю та водню.
- алкени
- Алкіни
- Алкадієни
- Цикли
- велосипедистів
- Ароматичні
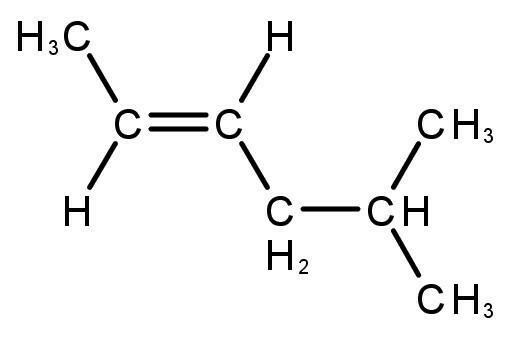
Також читайте про:
- Хімічні зв’язки
- Органічна хімія
- Органічні функції
Номенклатура
Номенклатура вуглеводнів визначається такими термінами:
| ПРЕФІКС | ПОСЕРЕДНИК | СУФІКС |
|---|---|---|
| Позначає кількість вуглецю, присутнього в ланцюзі. | Тип посилання, знайденого в рядку. | Ідентифікація функціональної групи. |
| ПРЕФІКС | ПОСЕРЕДНИК | СУФІКС | ||
|---|---|---|---|---|
| 1С | MET | Тільки одне посилання | АН | О |
| 2С | ET | |||
| 3С | ПРОП | подвійний зв’язок | EN | |
| 4С | АЛЕ | |||
| 5С | ПЕНТ | дві подвійні зв'язки | ДІЄН | |
| 6С | ШІСТИНЯ | |||
| 7С | HEPT | потрійне посилання | В |
|
| 8С | ЖОВТ | |||
| 9С | НЕ | Дві потрійні ланки | DIIN | |
| 10С | DEC |
Приклади
Прослідкуйте, як утворюються назви вуглеводнів:
| Етан |
- Префікс: ET, що відповідає 2 вуглецям.
- Посередник: АН, що відповідає одиничним посиланням.
- Суфікс: О, що відповідає функції вуглеводнів.
Подивіться на інші приклади:
| Пропан | |
| Ефін | |
| Етіно | |
| пропадієн |
У деяких випадках необхідно вказати положення подвійного або потрійного зв'язку. Нумерація повинна починатися з найближчого кінця цього посилання.
| 1,3-бутадієн | |
| 1-бутин |
Дізнайтеся більше на:
- Бутан
- Метан
Типи вуглеводнів
Ознайомтеся з основними типами вуглеводнів, їх характеристиками та використовуваними сполуками:
алкани
Вони являють собою відкриті ланцюги вуглеводнів з одинарними зв’язками між атомами вуглецю та водню, загальною формулою яких є ÇнемаєH2n + 2.
Характеристики алканів
- Їх ще називають парафінами або парафінами.
- Вони містяться в природі в природному газі та нафті.
- Використовуються як паливо: кулінарний газ, бензин, дизельне масло та ін.
Приклади алканів

алкени
Вони є відкритими ланцюгами вуглеводнів і мають подвійний зв’язок, загальною формулою якого є ÇнемаєH2н.
Характеристики алкенів
- Їх також називають олефінами, алкенами або етиленовими вуглеводнями.
- Їх отримують промисловим способом при крекінгу алканів, присутніх в олії.
- Вони використовуються як сировина в промисловості: пластмаси, барвники, вибухові речовини тощо.
Приклади алкенів

Алкіни
Вони являють собою відкриті ланцюги вуглеводнів з наявністю подвійного зв’язку, загальною формулою яких є ÇнемаєH2n-2.
Характеристики алкінів
- Вони є більш реактивними, ніж алкани та алкени завдяки потрійному зв’язку.
- Алкіни з понад 14 атомами вуглецю є твердими.
- Найбільш уживаним алкіном є ацетилен, який зазвичай використовується у виробництві синтетичних каучуків, текстильних волокон та пластмас.
Приклади алкінів

Алкадієни
Вони являють собою вуглеводні з відкритим ланцюгом та наявність двох подвійних зв’язків, загальною формулою яких є ÇнемаєH2n-2
Характеристика алкадієнів
- Також їх називають дієнами або діолефінами
- Вони містяться в природі в терпенах, які добувають з ефірних фруктових олій.
- Найвідомішою сполукою є ізопрен, що міститься в натуральному каучуку та ефірних оліях.
Приклади алкадієнів

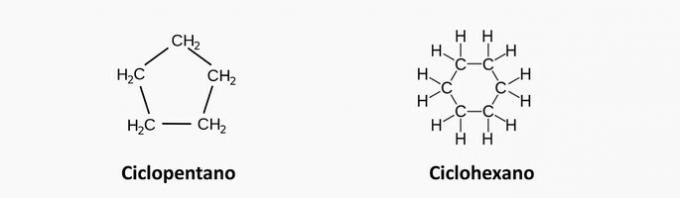
Циклани
Вони являють собою вуглеводні із замкнутим ланцюгом з одинарними зв’язками між атомами вуглецю та водню, загальною формулою яких є ÇнемаєH2н.
Характеристики цикланів
- Їх ще називають циклоалканами або циклопарафінами.
- Вони піддаються високому тиску нестійкі.
- Ланцюги з вмістом вуглецю більше 6 є стабільними, тоді як ланцюги з вмістом вуглецю менш ніж 5 є реакційноздатними.
Приклади цикланів

Цикли
Вони являють собою вуглеводні із замкнутим ланцюгом з наявністю подвійного зв’язку, структурною формулою якого є ÇнемаєH2n-2.
Характеристика циклів
- Їх ще називають циклоалкенами.
- З'єднання від 3 до 5 вуглеводнів нестійкі.
- Зазвичай вони містяться в природному газі, нафті та нафті.
Приклади циклів
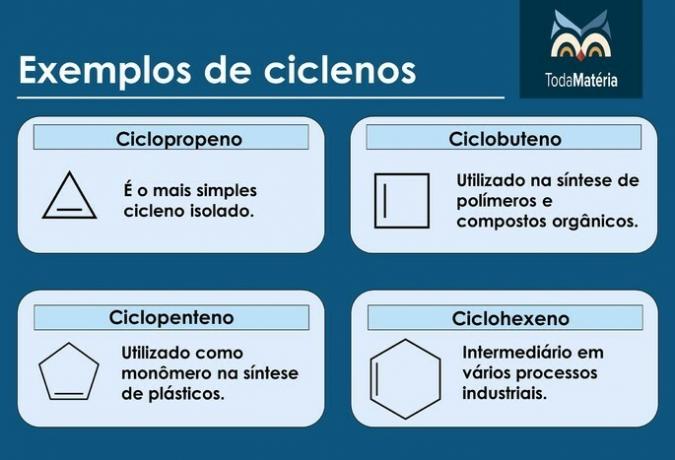
велосипедистів
Вони являють собою вуглеводні із замкнутим ланцюгом з наявністю потрійного зв’язку, структурною формулою якого є ÇнемаєH2n-4.
Характеристики їзди на велосипеді
- Їх ще називають циклоалкінами або циклоалкінами.
- Вони являють собою циклічні та ненасичені вуглеводні.
- Вони нестійкі внаслідок потрійного зв’язку і в природі не зустрічаються.
Приклади циклінів

Ароматичні
Вони являють собою вуглеводні із замкнутим ланцюгом із змінними одинарними та подвійними зв’язками.
Характеристика ароматичних речовин
- Їх ще називають аренами.
- Вони є ненасиченими сполуками, оскільки мають 3 подвійні зв’язки.
- Вони складаються щонайменше з одного ароматичного кільця.
Приклади ароматичних речовин
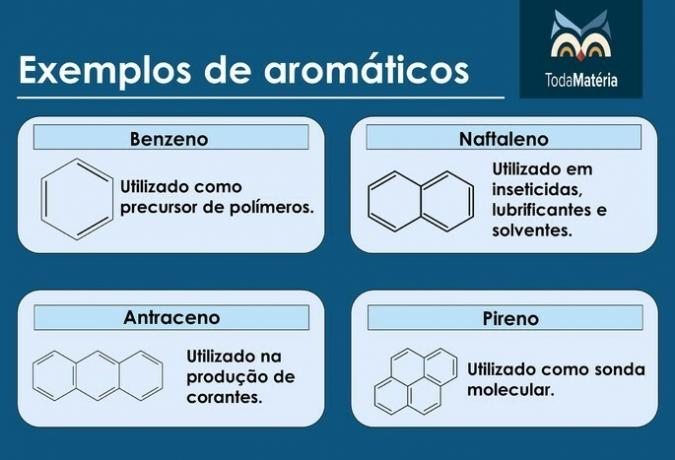
- Нафта
- переробка нафти
- Ацетилен
Вуглеводні Резюме
| Окупація | Загальна формула |
Особливості |
|---|---|---|
| алкан | Розкритий ланцюжок з простими ланками. |
|
| алкен | Розкритий ланцюг з подвійним зв’язком. | |
| алкін | Розкритий ланцюг з потрійним зв’язком. | |
| алкадієн | Розкритий ланцюг з двома подвійними зв'язками. | |
| Циклани | Замкнутий ланцюг з простими з'єднаннями. | |
| Цикли | Замкнутий ланцюг з подвійним зв’язком. | |
| велосипедистів | Замкнутий ланцюг з потрійною ланкою. | |
| Ароматичний | Змінна | Замкнута ланцюг з чергуванням одинарних і подвійних зв'язків. |
Вправи на вуглеводні
1. (UEMA) Зріджений газ (скраплений нафтовий газ), також відомий у народі як кулінарний газ, є паливом не відновлювана копалина, яка може закінчитися за ніч, якщо не використовувати її з плануванням та без неї надлишок. Він складається, серед інших газів, з пропану С3H8, бутан С4H10 і невелика кількість пропілену С3H6 і бутен С4H8. Ці органічні сполуки класифікуються як вуглеводні, що мають подібність та відмінності між собою. Виходячи з типу зв’язку вуглецю та класифікації вуглецевого ланцюга сполук вище, можна констатувати, що:
а) ненасиченими сполуками є пропан і бутан.
б) ненасиченими сполуками є пропен і бутен.
в) ненасиченими сполуками є пропен і бутан.
г) сполуки мають гомоциклічні ланцюги.
д) сполуки мають гетероциклічні ланцюги.
Альтернатива b) ненасиченими сполуками є пропен і бутен.
а) НЕПРАВИЛЬНО. Ці сполуки не мають ненасичених речовин, їх зв’язки прості.
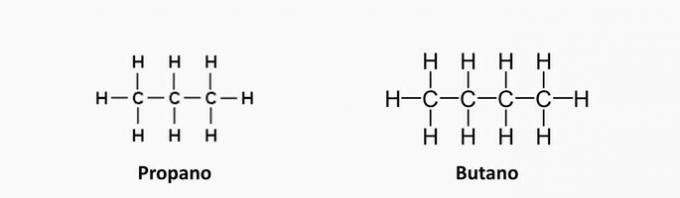
б) ПРАВИЛЬНО. Термін "en" вказує на наявність подвійних зв'язків у сполуках.

в) НЕПРАВИЛЬНО. Бутан не має ненасичень.

г) НЕПРАВИЛЬНО. Ці ланцюги замкнуті, а атоми Карбону пов'язані одинарними зв'язками.
д) НЕПРАВИЛЬНО. Ці ланцюги мають гетероатом, такий як кисень та азот.

2. (Uel) Один із вуглеводнів формули C.5H12 може мати вуглецевий ланцюг:
а) насичений циклічний.
б) неоднорідні ациклічні.
в) розгалужений циклічний.
г) ненасичений відкритий.
д) відкриті розгалужені.
Альтернатива д) відкрито розгалужена.
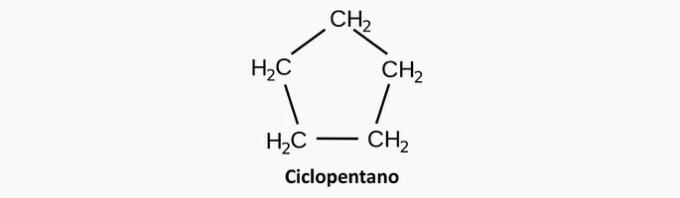
а) НЕПРАВИЛЬНО. Насичена циклічна сполука відповідає циклану, формулою якого є СнемаєH2н.
Приклад:
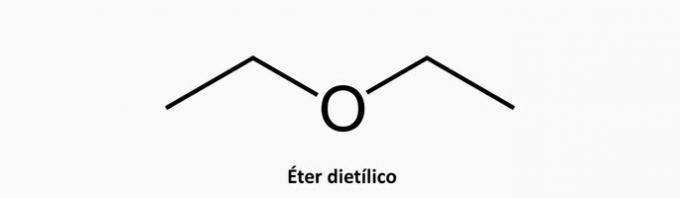
б) НЕПРАВИЛЬНО. Неоднорідна ациклічна сполука має присутність ще одного елемента на додаток до інтеркальованого вуглецю в ланцюзі.
Приклад:
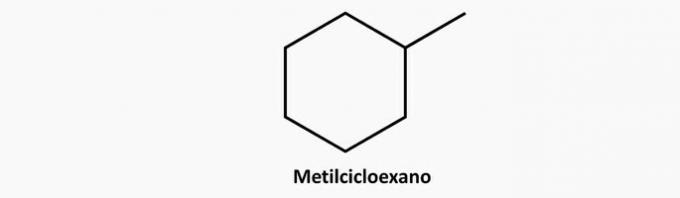
в) НЕПРАВИЛЬНО. Розгалужена циклічна сполука має формулу СнемаєH2н.
Приклад:
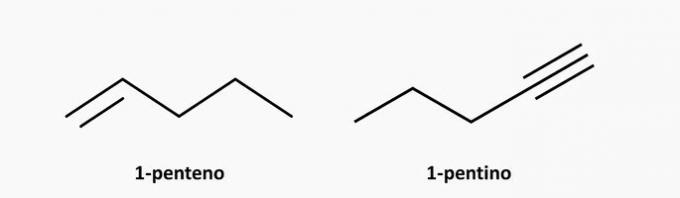
г) НЕПРАВИЛЬНО. Ненасиченою сполукою з відкритим ланцюгом може бути алкен або алкін, формулою яких є відповідно C.немаєH2н і СнемаєH2n-2.
Приклади:
д) ПРАВИЛЬНО. Розгалужена сполука з відкритим ланцюгом - це алкан, формулою якого є CнемаєH2n + 2. Сполукою з 5 вуглеводів і 12 воднів може бути ізопентан.
Приклад:
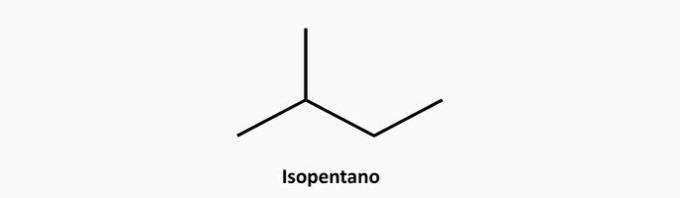
3. (PUC) Алкіни - це вуглеводні:
а) насичені аліфатики.
б) насичені аліцикліки.
в) ненасичені аліфатики з подвійним зв’язком.
г) ненасичені аліцикліки потрійного зв’язку.
д) потрійно зв’язані ненасичені аліфатики.
Альтернатива д) ненасичені аліфатики потрійного зв’язку.
а) НЕПРАВИЛЬНО. Відкрито-ланцюгові та однозв’язані сполуки є алканами.
Приклад:

б) НЕПРАВИЛЬНО. Циклічні сполуки з одинарними зв’язками є цикланами.
Приклад:
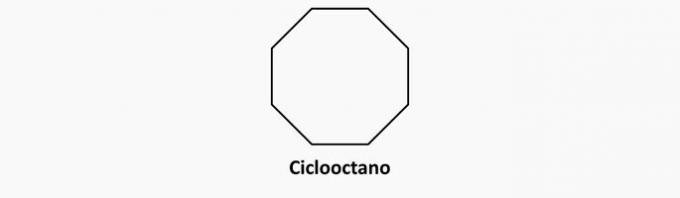
в) НЕПРАВИЛЬНО. Відкрито-ланцюгові та подвійнозв’язані сполуки є алкенами.
Приклад:
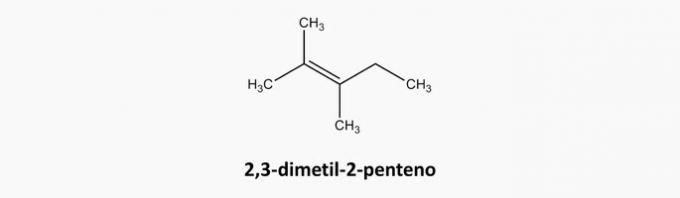
г) НЕПРАВИЛЬНО. Циклічні та потрійні зв’язки - це цикліни.
Приклад:
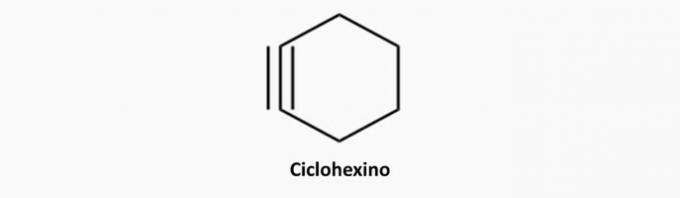
д) ПРАВИЛЬНО. Алкіни - це сполуки з відкритим ланцюгом та потрійним зв’язком.

Ви хочете продовжувати перевіряти свої знання? Обов’язково ознайомтесь із цими списками:
- Вправи на вуглеводні
- Вправи з органічної хімії
- Вправи на органічні функції

