Експерименти - це практичний спосіб засвоїти та перевірити свої знання понять, що вивчаються в хімії.
Скористайтеся перевагами цих хімічних експериментів, які можна проводити вдома (під наглядом дорослих) або працювати в класі разом із викладачем, щоб доповнити ваше навчання.
Перший досвід - розгадування кольорів
Поняття: хроматографія та розділення сумішей
Матеріали
- різнокольорові маркери
- алкоголь
- кавовий фільтрувальний папір
- чашка (скляна для полегшення моніторингу експерименту)
Як зробити
- Використовуйте ножиці та виріжте смужки фільтрувального паперу. Для кожної використовуваної ручки зробіть прямокутник.
- Тепер, на відстані приблизно 2 см від основи, намалюйте коло обраним кольором ручкою і зафарбуйте всередині.
- Наклейте край паперу, що знаходиться найдальше від намальованого мармуру, на підставку. Для цього можна використовувати стрічку і прикріпити її до олівця.
- Додайте в склянку алкоголю, не надто багато, оскільки він повинен просто торкатися кінця паперу біля позначки пера.
- Помістіть папір у чашку так, щоб вона була вертикальною. Олівець, який його підтримує, повинен спиратися на краї.
- Зачекайте від 10 до 15 хвилин, поки алкоголь підніметься через фільтрувальний папір. Після цього вийміть папери і дайте їм висохнути.
Результат
Коли алкоголь проходить марку ручки, він взаємодіє з кольоровими компонентами і рухає їх по папері. Таким чином, різні пігменти будуть розділятися при контакті зі спиртом.
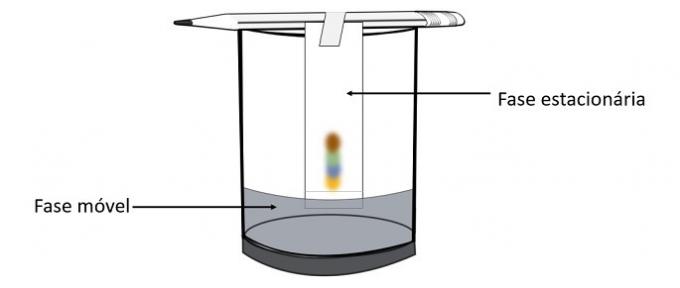
Завдяки цьому експерименту можна дізнатись, які кольори змішували, щоб створити колір пера.
Пояснення
Хроматографія - це тип процесу розділення сумішей. Фільтрувальний папір є нерухомою фазою, а спирт - рухливою фазою, яка затягує компоненти суміші під час її проходження через нерухому фазу. У цьому процесі, чим більша взаємодія зі спиртом, тим швидше пігмент буде рухатися з проходженням розчинника.
Складові матеріалу, оскільки вони мають різні властивості, будуть взаємодіяти з рухомою фазою по-різному, що можна помітити за різним часом опору в стаціонарній фазі.
Дізнайтеся більше про хроматографія.
2-й досвід - збереження їжі
Поняття: органічні сполуки та хімічні реакції
Матеріали
- яблуко, банан або груша
- лимонний або апельсиновий сік
- Таблетка вітаміну С
Як зробити
- Виберіть один із трьох плодів і розріжте його на 3 рівні частини.
- Перший шматок послужить порівнянням з іншими. Тому нічого до нього не додайте, просто залиште його на повітрі.
- У одну з частин капніть вміст лимона або апельсина. Розкладіть так, щоб вся внутрішня частина плодів була покрита соком.
- В останню частину розподіліть вітамін С, це може бути подрібнена таблетка по всій м’якоті плодів.
- Поспостерігайте, що відбувається, і порівняйте результати.
Результат
М’якоть плодів, що потрапили на повітря, повинна швидко потемніти. Лимонний або апельсиновий сік і вітамін С, хімічна речовина під назвою аскорбінова кислота, повинні уповільнювати підрум’янення плодів.

Пояснення
Коли ми ріжемо плід, його клітини пошкоджуються, виділяючи ферменти, такі як поліфенолоксидаза, яка в при контакті з повітрям фенольні сполуки, що містяться в їжі, окислюють і викликають ферментативне підрум'янення.
Для запобігання дії кисню застосовують такі консерванти, як аскорбінова кислота, оскільки вони переважно окислюються замість фенольних сполук. На додаток до таблетки вітаміну С, аскорбінова кислота також присутня в природних джерелах, таких як цитрусові, лимон та апельсин, запропоновані в експерименті.
Дізнайтеся більше про окислення.
3-й досвід - хто швидше замерзає?
Залучені поняття: колігативні властивості та кріоскопія
Матеріали
- дві трубки (використовуються для вечірок)
- скляна чаша
- кухонна сіль
- відфільтрована вода
- лід
- термометр
Як зробити
- Додайте однакову кількість відфільтрованої води в обидві пробірки. Наприклад, по 5 мл у кожну пробірку.
- Додайте кухонну сіль в одну з пробірок і покладіть ідентифікаційну стрічку, щоб розрізнити, яка з них солона.
- Наповніть скляну ємність подрібненим льодом і додайте трохи солі.
- Помістіть дві трубки одночасно всередину льоду і спостерігайте за тим, що відбувається.
- Запишіть температуру замерзання для кожної ситуації.
Результат
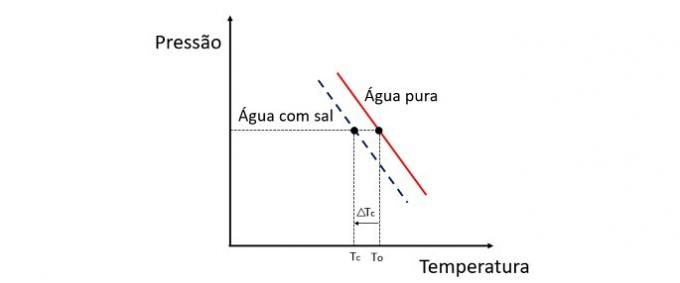
Додавання розчиненої речовини у воду знижує температуру замерзання. Тому звичайна вода, як правило, замерзає набагато швидше, ніж розчин солі та води, потрапляючи в однакові умови.
Пояснення
Кріоскопія - колігативна властивість, яка вивчає зміну температури розчинника при розчиненні в ньому різної кількості розчиненої речовини.
Зниження температури замерзання води спричинене нелеткою розчиненою речовиною, і це явище має багато практичних застосувань. Тому більша концентрація розчиненої речовини в розчині впливає на кріоскопічний ефект.
Якщо, наприклад, вода замерзає при 0 ° C і ми додаємо в неї сіль, температура зміни фази буде негативною, тобто набагато нижчою.
Ось чому морська вода не замерзає в місцях, температура яких нижче 0 ° C. Сіль, розчинена у воді, має тенденцію до подальшого зниження температури замерзання. У місцях, де сніг, також прийнято кидати сіль на дороги, щоб розтопити лід і уникнути аварій.
Дізнайтеся більше про колігативні властивості.
4-й експеримент - розкладання перекису водню
задіяні поняття: хімічна реакція та каталізатор
Матеріали
- Половина сирої картоплі і наполовину зварена
- Шматок сирої печінки та ще один варений шматок
- Перекис водню
- 2 страви
Як зробити
- У кожну страву додайте їжу, картоплю разом і печінку разом.
- У кожен з чотирьох матеріалів додають по 3 краплі перекису водню.
- Поспостерігайте, що відбувається, і порівняйте результати.
Результат
Перекис водню, розчин перекису водню, потрапляючи в контакт із сирими продуктами, починає шипити майже миттєво.
Цей експеримент також можна провести, додавши шматок їжі в ємність з перекисом водню, щоб зробити реакцію більш помітною.
Пояснення
Шипучість пероксиду водню при контакті з сирими продуктами характеризує виникнення хімічної реакції, яка полягає в розкладанні перекису водню і виділенні газу кисень.
Розкладання перекису водню відбувається під дією ферменту каталази, що знаходиться в органелах пероксисом, присутніх у клітинах тварин і рослин.
Важливо підкреслити, що розкладання перекису водню відбувається спонтанно, у присутності сонячного світла, але при дуже повільній реакції. Однак каталаза діє як каталізатор, збільшуючи швидкість хімічної реакції.
Перекис водню може бути токсичною речовиною для клітин. Тому каталаза розщеплює сполуку і виробляє воду та кисень - дві речовини, які не шкодять організму.
Коли їжа готується, її компоненти зазнають змін. Модифікації, спричинені варінням, також компрометують дію каталази, денатуруючи білок.
Те саме, що ми спостерігаємо з їжею, відбувається і тоді, коли ми наносимо на рану перекис водню. Каталаза діє і відбувається утворення бульбашок, що полягає у виділенні кисню.
Дізнайтеся більше про хімічні реакції.
Бібліографічні посилання
СВЯТІ, В. Л. П.; МОЛ, Г. С. (Coords.). Громадянин Хімія. 1. вид. Сан-Паулу: Нове покоління, 2011. v. 1, 2, 3.
БРАЗИЛЬСЬКЕ ХІМІЧНЕ СУСПІЛЬСТВО (організація) 2010. Хімія поруч із вами: недорогі експерименти для класу К-12. 1. вид. Сан-Паулу.