Температура плавлення та температура кипіння представляють температуру, при якій речовина змінює стан при заданому тиску.
У разі точки плавлення речовина переходить із твердого стану в рідкий. Температура кипіння відноситься до переходу з рідкого стану в газоподібний.
Наприклад, лід починає перетворюватися на воду у рідкій формі, коли його температура дорівнює 0 ° C. Отже, температура плавлення води дорівнює 0 ° C (під тиском 1 атмосфера).
Щоб перейти з рідини на пару, вода повинна досягти температури 100 ° C. Таким чином, температура кипіння води становить 100 ° С (під тиском 1 атмосфера).

Точка плавлення
Коли речовина у твердому стані отримує тепло, спостерігається збільшення ступеня збудження його молекул. Отже, його температура також підвищується.
При досягненні певної температури (точки плавлення) збудження молекул таке, що порушує внутрішні зв’язки між атомами та молекулами.
У цей момент речовина починає змінювати свій стан і переходить у рідкий стан, якщо продовжує отримувати тепло.
Під час Злиття його температура залишається постійною, оскільки отримане тепло використовується виключно для зміни стану.

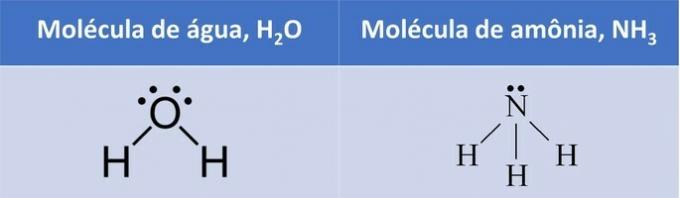
Тепло на одиницю маси, необхідне для зміни фаз, називається приховане тепло плавлення (Lf) і є характеристикою речовини.
Температура плавлення і прихована температура
У таблиці нижче ми вказуємо температуру плавлення і приховану теплоту деяких речовин до атмосферний тиск.
Точка кипіння
THE кипіння він характеризується швидким переходом з рідини в газоподібний стан з утворенням парів (бульбашок) всередині рідини.
Як і при плавленні, існує температура (температура кипіння), при якій дана речовина переходить з рідкого в газоподібний стан.
Щоб це відбулося, речовина повинна отримувати тепло. Протягом усієї фазової зміни температура залишається постійною.
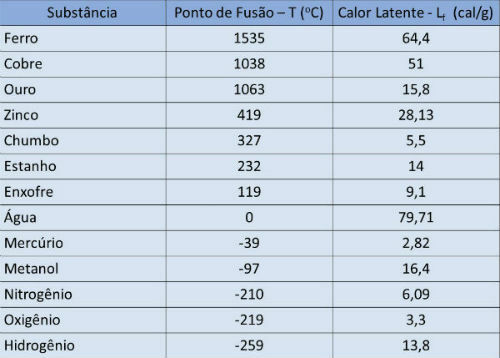
приховане тепло випаровування (Lv) - кількість теплоти на одиницю маси, необхідна речовині для зміни фази.
Температура кипіння і таблиця прихованого нагрівання
У таблиці нижче ми вказуємо температуру кипіння та приховану теплоту випаровування деяких речовин при атмосферному тиску.
Перешкоди тиску
Температура точки плавлення і температури кипіння залежить від тиску, що чиниться на речовину.
Загалом речовини збільшуються в обсязі, коли піддаються плавленню. Цей факт означає, що чим вищий тиск, тим вища температура речовини для зміни фази.
Виняток трапляється з деякими речовинами, включаючи воду, яка при плавленні зменшує свій об’єм. У цьому випадку вищий тиск знизить температуру плавлення.

Зниження тиску призводить до того, що температура кипіння даної речовини стає нижчою, тобто речовина буде кипіти при нижчій температурі.
Наприклад, місцями над рівнем моря вода кипить при температурі нижче 100 ° С. Як результат, готування в цих місцях займає набагато більше часу, ніж у місцях на рівні моря.
Читайте також:
- Зміни фізичного стану
- Термометричні ваги
- Термометричні ваги - Вправи
- Фізичний стан води
- Діаграма фаз
- Затвердіння
- Конденсація
- Колігативні властивості
- Періодичні властивості
- Випаровування
- Вправи на Періодичній системі