* Теорія Арренія:
На основі його експериментів з електропровідністю у водних середовищах, хімічних, фізичних та математичних Швед Сванте Август Арреніус (1859-1927) запропонував у 1884 р. Наступні поняття для визначення кислот і бази:

Отже, загалом ми маємо:
H+ + H2O → H3О+
Приклади:
HCl + H2O → H3О++ Кл-
HNO3+ H2O → H3О+ + НІ3-
H2ТІЛЬКИ4+ 2Н2O → 2H3О+ + ОС42-

Приклади:
NaOH → Na + + ОН-
Ca (OH)2 → Ca2+ + 2 ОН-
* Теорія Бренстеда-Лоурі:
Незалежно від цього, датчанин Йоганнес Ніколаус Бренстед (1879-1947) та англійський Томас Мартін Лоурі (1874-1936), запропонував того ж року ще одну кислотно-лужну теорію, відому як теорія Бренстеда-Лоурі, яка говорить, що Наступне:

У цьому випадку іон водню вважається протоном. Це видно з наступної реакції, коли синильна кислота віддає протон у воду, який, отже, діє як основа:
HCN + H2O → CN- + H3О+
Ця реакція є оборотною з іоном гідронію (H3О+) може віддавати протон іону CN-. Таким чином, іон гідронію (H3О+) діє як кислота і CN- як основа.
CN- + H3О+→ HCN + H2О
* Теорія Льюїса:
Ця теорія була створена американським хіміком Гілбертом Ньютоном Льюїсом (1875-1946) і говорить наступне:

Ця теорія вводить нову концепцію, є більш вичерпною, але не робить теорію Бренстеда-Лоурі недійсною. Бо кожна кислота Льюїса є кислотою Бренстеда, а отже кожна основа Льюїса є основою Бренстеда. Це пов’язано з тим, що протон отримує електрони, тобто кислота Льюїса може приєднуватися до самотньої пари електронів в основі Льюїса.
Для Льюїса кислотно-лужна реакція складається з утворення більш стабільного координованого ковалентного зв’язку. Отже, коли основа Льюїса віддає пару електронів на базу Льюїса, вони обидва утворюють координатний ковалентний зв’язок, в якому обидва електрони походять від одного з атомів, як у прикладі нижче:
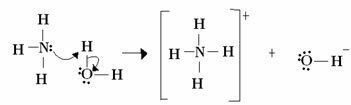
У цьому випадку аміак діє як основа Льюїса і Бренстеда, оскільки він віддає свої два електрони протону і, отже, є приймачем протона. Крім того, між воднем (протоном) та аміаком утворився ковалентний зв’язок.
Вода - це кислота Льюїса і кислота Бренстеда, оскільки вона віддає протон і отримує електрони, зауважте, як кисень у гідроксиді, що утворюється з води, має зайву пару електронів.

Дженніфер Фогача
Закінчив хімію
Шкільна команда Бразилії.
Джерело: Бразильська школа - https://brasilescola.uol.com.br/quimica/teorias-acidobase-arrheniusbronstedlowry-lewis.htm
