Розподіл електронів або електронна конфігурація за впорядкуванням хімічних елементів, враховуючи кількість їх електронів та їх близькість до атомного ядра.
Електронний багаторівневий розподіл
Після появи декількох атомних моделей модель Бора запропонувала організувати електросферу на орбітах.
Електрони організовуються і розподіляються по електронних шарах, деякі знаходяться ближче до ядра, а інші - далі.
Потім з’явились 7 електронних шарів (K, L, M, N, O, P та Q), які представлені горизонтальними лініями, пронумерованими в періодичній таблиці від 1 до 7.
Елементи на одних і тих самих лініях мають однакову максимальну кількість електронів, а також однакові рівні енергії.
Таким чином, можна спостерігати, що електрони знаходяться на енергетичних рівнях і підрівнях. Отже, кожен має певну кількість енергії.
|
Рівень енергії |
Електронний шар |
Максимальна кількість електронів |
|---|---|---|
| 1° | К | 2 |
| 2° | L | 8 |
| 3° | М | 18 |
| 4° | N | 32 |
| 5° | О | 32 |
| 6° | P | 18 |
| 7° | Питання | 8 |
THE валентний шар це останній електронний шар, тобто самий зовнішній шар атома. Відповідно до
Правило Октету, атоми мають тенденцію стабілізуватися і стати нейтральними.Це трапляється, коли вони мають однакову кількість протонів і нейтронів з вісьмома електронами в останній електронній оболонці.
Пізніше з'явилися підрівні енергії, представлені малими літерами s, p, d, f. Кожен підрівень підтримує максимальну кількість електронів:
| підрівні | Максимальна кількість електронів |
|---|---|
| s | 2 |
| P | 6 |
| d | 10 |
| f | 14 |
Діаграма Полінга
Американський хімік Лінус Карл Полінг (1901-1994) вивчав атомні структури і розробив схему, яка використовується і сьогодні.
Полінг знайшов спосіб поставити всі енергетичні підрівні у порядку зростання, використовуючи діагональний напрямок. Схема стала відомою як Діаграма Полінга.
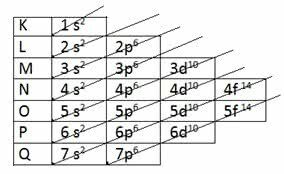
В порядку зростання: 1с2 2с2 2р6 3 с2 3п6 4 с2 3d10 4р6 5 с2 4г10 5р6 6 с2 4f14 5г10 6с6 7 с2 5f14 6г10 7р6
Зверніть увагу, що число, вказане перед енергетичним підрівнем, відповідає рівню енергії.
Наприклад, через 1с2:
- s вказує на енергетичний підрівень
- 1 позначає перший рівень, розташований на шарі К
- показник 2 позначає кількість електронів у цьому підрівні
Як зробити електронний розподіл?
Щоб краще зрозуміти процес електронного розподілу, подивіться на розв’язану вправу нижче.
1. Зробіть електронний розподіл елемента Залізо (Fe), який має атомний номер 26 (Z = 26):
При застосуванні діаграми Лінуса Полінга діагоналі проходять у напрямку, зазначеному на моделі. Енергетичні підрівні заповнюються максимальною кількістю електронів на електронну оболонку до завершення 26 електронів елемента.
Для розподілу зверніть увагу на загальну кількість електронів у кожному підрівні та у відповідних електронних шарах:
К - с2
L - 2 с2 2р6
М - 3 с2 3п6 3d10
N - 4 с2
Зверніть увагу, що не потрібно було робити електронний розподіл у всіх шарах, оскільки атомний номер заліза дорівнює 26.
Таким чином, електронний розподіл цього елемента представлений таким чином: 1с2 2с2 2р6 3 с2 3п6 4 с2 3d6. Сума чисел показника становить 26, тобто загальна кількість електронів, присутніх в атомі заліза.
Якщо електронний розподіл позначається шарами, він представляється таким чином: K = 2; L = 8; М = 14; N = 2.
Скористайтеся можливістю перевірити свої знання в Вправи з електронного розподілу.
В Періодична таблиця, це показано наступним чином:

Читайте також:
- Електронна спорідненість
- Квантові числа
- Вправи на Періодичній системі
- Вправи з упорядкування періодичної системи


