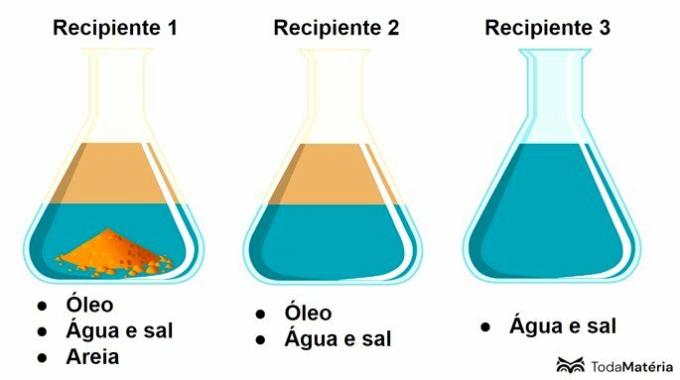
Солі - це хімічні речовини, утворені іонними зв’язками між атомами. Функція неорганічної солі відповідає іонним сполукам, які мають принаймні один катіон, відмінний від Н+ і аніон, відмінний від ОН-.
Солі присутні в нашому повсякденному житті, широко використовуються в їжі, а також в інших областях. Вони є приклади солей:
- Хлорид натрію (NaCl): у народі відомий як кухонна сіль
- Карбонат кальцію (CaCO3): присутній у мармурі та вапняку
- Сульфат кальцію (CaSO4): складає шкільну крейду та гіпс
- Бікарбонат натрію (NaHCO3): використовується у кулінарії, медицині та як засіб для чищення
Ці речовини, як правило, утворюються в результаті реакції нейтралізації, коли кислота та підстава реагують, утворюючи сіль і воду.
HCl(кислота) + NaOH (база) → NaCl(сіль) + H2О(Вода)
У цій реакції реагенти соляна кислота (HCl) та гідроксид натрію (NaOH) утворюють продукти хлориду натрію (NaCl) та води (H2О).
При іонному зв'язку відбувається при передачі електронів між атомами, і для цього один з атомів повинен бути металом, а інший неметалом. При цьому утворюються позитивні хімічні види - катіони, що віддають електрони, і негативно заряджені - аніони, які їх отримали.
Спостерігайте на зображенні нижче, як утворюється хлорид натрію (NaCl).

Атом металу натрію (Na) віддає електрон атому хлору (Cl). Таким чином, утворюється катіон Na+, який складається з позитивного іона натрію та аніона Cl-, що відповідає негативному іону хлору.
знати більше про кислоти та основи.
Характеристика солей
Важливо зазначити, що у водному розчині кислоти завжди виділяють катіон Н+ і основи вивільняють аніон OH- (Концепція Арреніуса).
Однак солі не завжди мають однаковий катіон або аніон і, з цієї причини, не виявляють чітко визначених функціональних властивостей. Однак можна сказати, що загалом:
- Вони є іонними сполуками (утвореними скупченнями іонів, а не молекулами);
- Багато з них мають характерний солоний присмак (майже завжди отруйний);
- Вони тверді і кристалічні;
- Провести електричний струм у розчині;
- Вони плавляться і киплять при високій температурі;
- Розчинний у воді (винятки: деякі сульфіди; хлориди, броміди та йодиди з катіонами Ag+, рт. ст22+ та Pb2+, між іншими).
Також читайте про хімічні функції.
Класифікація та номенклатура солей
За способом реакції утворення солі їх класифікують на три типи:
Нейтральні або звичайні солі
Реакція тотальної нейтралізації (всі реакції Н+ кислоти та всіх ОН- основи). Ці солі при розчиненні у воді не змінюють рН.
Приклади:
NaOH (основа) + HCl (кислота) → NaCl (нормальна сіль) + H2О
3NaOH (основа) + H3ПИЛ4 (кислота) → Na3ПИЛ4 (нормальна сіль) + 3Н2О
Назва звичайних солей: назва солі походить від назви кислотного аніона, закінчення якого _гідричний або _oso або _ico буде замінено відповідно на: _ето ou_ito або _act і основний катіон.
Сіль = (назва аніона) + суфікс ето / іто / актв (катіонна назва).
Отже:
- кислота хлоргідричний (HCl) + гідроксид натрію (NaOH) → хлоретонатрію (NaCl) + вода
- кислота нітраткістка(HNO2) + гідроксид калію(KOH) → нітратдуже калію(KNO2) + вода
- кислота ортофосфорich (2 год3ПИЛ4) + гідроксид кальцію(3Ca (OH)2 → ортофосфдіяти кальцію [Ось3(ПИЛ4)2] + вода (6H2O)
Кислі солі або солі водню
Реакція часткової нейтралізації кислоти (коли не всі H+ кислоти реагують, тому сіль має у своїй структурі один або кілька іонізуючих воднів кислоти).
Приклад:
NaOH (основа) + H2ТІЛЬКИ4 (кислота) → NaHSO4 (кислотна сіль) + Н2О
Назва кислотних солей: подібний до звичайних солей, але із зазначенням числа Н+ за префіксами моно, ді, тритощо
Sal = префікс числа H+ + (назва аніона) + суфікс ето / іто / актв (катіонна назва).
кислота сіркаich (H2ТІЛЬКИ4) + гідроксид натрію(NaOH) → моногідрогенсіркадіятив натрію (NaHSO4) + вода
кислота ортофосфорich (H3ПИЛ4) + гідроксид натрію(NaOH) → дигідроген-ортофосфдіяти натрію (NaH2ПИЛ4) + вода
Основні солі або гідроксисолі
Реакція часткової нейтралізації основи (Якщо не всі гідроксили реагують, сіль має один або кілька гідроксилів у своїй структурі).
Приклад:
Ca (OH)2 (основа) + HCl (кислота) → Ca (OH) Cl (основна сіль) + H2О
Назва основних солей: подібний до звичайних солей, але із зазначенням числа ОН- за своєю структурою.
Sal = префікс числа OH- + (назва аніона) + суфікс ето / іто / актв (катіонна назва).
кислота хлоргідричний (HCl) + гідроксид кальцію [Ca (OH)2] → моногідроксихлорето кальцію [Ca (OH) Cl] + вода
кислота хлоргідричний (2HCl) + гідроксид алюміній [Al (OH)3] → моногідроксихлоретов алюміній [Al (OH) Cl2] + вода
Подвійні або змішані солі
Реакція ді, три або тетрабази з різними основами (подвійна сіль для катіону) або ді, три або тетрабази з різними кислотами (подвійна сіль для аніону).
Приклади:
Що стосується катіону:
H2ТІЛЬКИ4 (діацидна кислота) + KOH (основа) + NaOH (основа) → KNaSO4 (подвійний сульфат калію та натрію) + 2Н2О
H3ПИЛ4 (трикислота) + 2KOH (основа) + NaOH (основа) → K2NaPO4 (монокальцій дикалій калію ортофосфат)
Що стосується аніону:
Ca (OH)2 (дибаз) + HBr (кислота) + HCl (кислота) → CaBrCl (хлорид-бромід кальцію) + 2H2О
Al (OH)3 (трибаза) + H2ТІЛЬКИ4(кислота) + HCl (кислота) → Al (SO4) Cl (сульфат хлориду алюмінію) + 3H2О
Знати головне неорганічні функції і обов’язково перевірте запитання щодо вступного іспиту з цього предмету, з коментарем, у: вправи на неорганічні функції.