Окисно-відновні реакції передбачають перенесення електронів між атомами, іонами або молекулами.
В реакції окислення-відновлення відбуваються зміни числа окислення (nox). Окси-відновлення складається з процесів окислення та відновлення:
- Окислення: призводить до втрата електронів і збільшений нокс.
- Скорочення: призводить до приріст електрона і зменшився нокс.
У міру того, як один елемент віддає електрони, інший отримає їх. Таким чином, загальна кількість отриманих електронів дорівнює загальній кількості втрачених електронів.
Приклади окисно-відновних реакцій на горіння, корозію та фотосинтез.
Приклади
Залежно від елемента, який приймає або віддає електрони, ми маємо такі назви:
- Відновник: Той, хто зазнає окислення, спричинює відновлення та збільшує нокс. Це те, що втрачає електрони.
- Окислювач: Той, який зазнає відновлення, викликає окислення і зменшує нокс-кількість. Це те, що отримує електрони.
О окисне число представляє електричний заряд елемента в той час, коли він бере участь у хімічний зв’язок.
Ця умова пов'язана з електронегативність, що є тенденцією деяких елементів до отримання електронів.
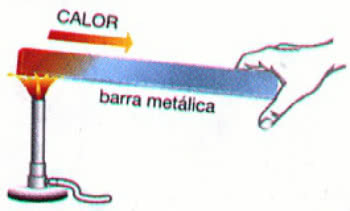
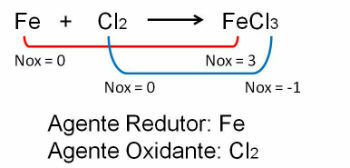
1. Зверніть увагу на перший приклад, зауважте, що в реакції між залізом та хлором відбувається зміна окисного числа. О хлор оскільки він більш електронегативний, він отримує електрони:
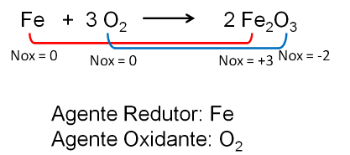
2. Реакція між залізом та киснем. Кисень є більш електронегативним і в кінцевому підсумку отримує електрони і зменшує їх окисне число.
Дізнайтеся більше, читайте також:
- Окислення
- Горіння
- Хімічні реакції
- електрони
Вправа вирішена
1. (PUC-RS) Щодо рівняння окислення - незбалансоване відновлення Fe0 + CuSO4 → Fe2(ТІЛЬКИ4)3 + Cu0, можна сказати, що:
а) число окислення міді в сульфаті міді становить +1.
б) атом заліза втрачає 2 електрони.
в) мідь зазнає окислення.
г) залізо - окислювач.
д) залізо зазнає окислення.
Дозвіл:
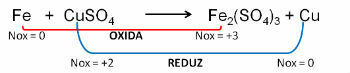
Відповідь:
д) залізо зазнає окислення.
Вправи
1. (UFAC-AC) У наступному хімічному рівнянні: Zn + 2 HCℓ → ZnCℓ2 + H2
а) елемент Zn окислюється і реагує як окислювач.
б) елемент Zn окислюється і реагує як відновник.
в) елемент Zn відновлюється і реагує як відновник.
г) HCℓ є відновником.
д) рівняння класифікується як оборотне.
б) елемент Zn окислюється і реагує як відновник.
2. (ITA-SP) В іонній реакції Ni (s) + Cu2+(aq) → Ni2+(aq) + Cu (s)
а) нікель є окисником, оскільки він окислюється.
б) нікель є відновником, оскільки він окислюється.
в) іон купруму є окисником, оскільки він окислюється.
г) іон купруму є відновником, оскільки він відновлюється.
д) це не окисно-відновна реакція, тому немає окислювача або відновника.
б) нікель є відновником, оскільки він окислюється.
3. (UFRGS) Активним агентом побутового відбілювача є іон гіпохлориту, ClO-. У процесах відбілювання цей іон відновлюється; Це означає що:
а) речовина, яка зазнає дії гіпохлориту, отримує електрони.
б) відбувається зменшення кількості електронів у його структурі.
в) ClO - відновник.
г) ClO- перетворюється на елементарний хлор або хлорид-іон.
д) не відбувається перенесення електрона.
г) ClO- перетворюється на елементарний хлор або хлорид-іон.