Гібридизація вуглецю sp-типу2 це відбувається, коли він має подвійний зв’язок і два одинарних зв’язки або зв’язок pi (π) і три сигма-зв’язки (σ). Насправді, sp гібридизація2 це відбувається між атомами, що встановлюють подвійний зв’язок.
Прикладом такої молекули є формальдегід (СН2О). Зверніть увагу на його структуру нижче:
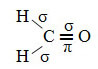
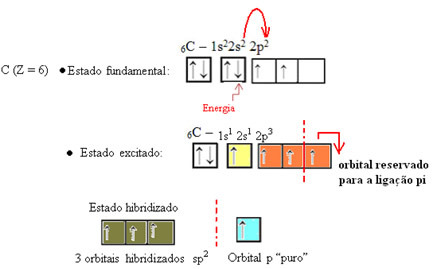
Як видно з тексту "гібридизація типу sp3", Гібридизація вуглецю відбувається, коли електрон з підрівню 2s отримує енергію і" транспортується "в 2p підрівні і, таким чином, походять 4 гібридизовані орбіталі із "суміші" атомних орбіталей чистий.
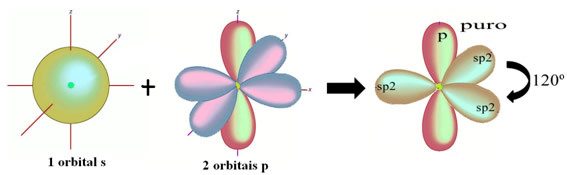
У випадку формальдегіду ми знаємо, що буде пі-зв'язок, тому одна з цих гібридизованих орбіталей зарезервована для цього зв'язку, тоді як інші три несуть сигма-зв'язки:
Атоми водню, які утворюють єдиний зв’язок з вуглецем, роблять це за своєю орбіталлю:
Решта "чисті" р-орбітальні подвійні зв'язки атома кисню і молекули формальдегіду мають таку структуру:
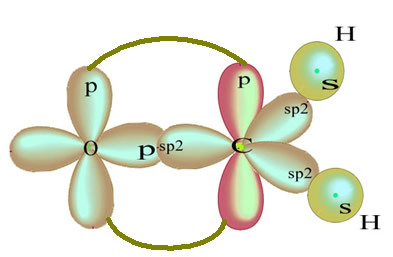
Що стосується типу зв’язків, що існують у цій структурі формальдегіду, ми маємо:

Зв'язки: 1 = 2 = σs-sp2
3 = σp-sp2
4 =πр-р
Дженніфер Фогача
Закінчив хімію
Джерело: Бразильська школа - https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp2.htm


