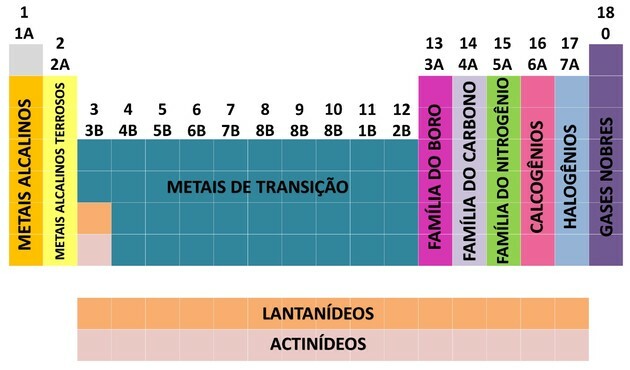
Одним із способів організації хімічних елементів є сім’ї, які відповідають вертикальним послідовностям періодичної системи.
В 18 колонок таблиці групують елементи за схожістю за хімічними властивостями.
Упорядкування хімічних елементів у сім'ї було практичним способом структурування різної знайденої інформації та простого їх подання.
Щоб полегшити розташування хімічного елемента, сім'ї були позначені цифрами від 1 до 18 наступним чином:
Завдяки внеску багатьох вчених та різним спробам упорядкувати дані періодична система розвивалася, встановлюючи порядок упорядкування елементів.
Номенклатура сімей
- Сім'ї в таблиці були розділені на A (представник) і B (перехід), ідентифікуючись буквами та цифрами.
- ти репрезентативні елементи сімейства 0, 1A, 2A, 3A, 4A, 5A, 6A та 7A відповідають.
- ти перехідні елементи сімейства 1B, 2B, 3B, 4B, 5B, 6B, 7B та 8B відповідають.
- За визначенням Міжнародного союзу чистої та прикладної хімії (IUPAC), сім'ї були визначені в групи від 1 до 18.
Періодична система та електронний розподіл
Подібність між елементами одного сімейства виникає тому, що число валентних електронів атома в основному стані однакове для членів певної групи.
Наприклад:
| Група 1 | Елетронний розподіл |
|---|---|
| 3читати | 2-1 |
| 11В | 2-8-1 |
| 19К | 2-8-8-1 |
| 37Rb | 2-8-18-8-1 |
| 55Cs | 2-8-18-18-8-1 |
| 87О | 2-8-18-32-18-8-1 |
Атоми групи 1 мають свої електрони, розподілені більш ніж на одному енергетичному рівні, але всі мають валентний електрон.
Зважаючи на це, ми спостерігаємо, що виготовлення електронний розподіл атома в основному стані, ми знаходимо його положення на таблиці Менделєєва.
репрезентативні елементи
Репрезентативні елементи демонструють відносно менш складну хімічну поведінку, ніж перехідні елементи, і утворюють більшість речовин навколо нас.
Деякі з представницьких сімейств елементів отримують спеціальні імена, як показано нижче:
Група |
Сім'я | конкретна назва | Походження імені | Елементи | електронна конфігурація |
|---|---|---|---|---|---|
| 1 | 1А | лужні метали | з лат луг, що означає «сірий колір рослин». | Li, Na, K, Rb, Cs та Fr | нас1 |
| 2 | 2А | лужноземельні метали | Термін "земний" відноситься до "існуючого на землі". | Be, Mg, Ca, Sr, Ba і Ra | нас2 |
| 13 | 3А | сім'я бору | Назва першого елемента родини. | B, Al, Ga, In, Tl і Nh. | нас2нп1 |
| 14 | 4А | вуглецева сім’я | Назва першого елемента родини. | C, Si, Ge, Sn, Pb і Fl. | нас2нп2 |
| 15 | 5А | Сім'я азоту | Назва першого елемента родини. | N, P, As, Sb, Bi і Mc. | нас2нп3 |
| 16 | 6А | Халькогени | від грец халки, оскільки вони є елементами, що містяться в мідних рудах. | O, S, Se, Te, Po та Lv. | нас2нп4 |
| 17 | 7А | Галогени | Грецький вираз, що означає солеутворювачі. | F, Cl, Br, I, At і Ts. | нас2нп5 |
| 18 | 0 | Благородні гази | Вважалося, що не вступає в реакцію з іншими речовинами. | Він, Ne, Ar, Kr, Xe, Re та Og. | 1с2 (Він) або ми2нп6 |
Через таблицю ми бачимо, що:
- Представлені вище елементи класифікуються як репрезентативні, оскільки вони мають найенергійніший електрон у s або p підрівні.
- Електрони розподіляються за енергетичними рівнями, а n являє собою самий зовнішній рівень атома в основному стані.
- Репрезентативні елементи, згідно з рекомендацією IUPAC, належать до груп або сімей 1,2,13,14,15,16,17 та 18.
О водень він класифікується окремо від інших елементів. Навіть з електронною конфігурацією 1s1, він не входить до групи 1 за подання особливої поведінки.
перехідні елементи
Елементи переходу відповідають групам 3-12. Цю назву вони отримали, оскільки мають проміжні характеристики між групами 1 і 2 та репрезентативними неметалевими елементами.
ти перехідних металів визначаються IUPAC як:
Перехідний елемент має неповний d підрівень або може утворювати катіони з неповним d підрівнем.
Коли найенергійніший електрон атома основного стану знаходиться в неповному підрівні, це характеризується як зовнішній перехід.
Лантаніди та актиноїди є внутрішніми перехідними елементами, оскільки вони мають принаймні один неповний підрівень.
Коли елементи мають електрони, що заповнюють d або f орбіталі, вони виявляють подібні властивості і можуть бути класифіковані як d або f орбіталі. зовнішній або внутрішній перехід.
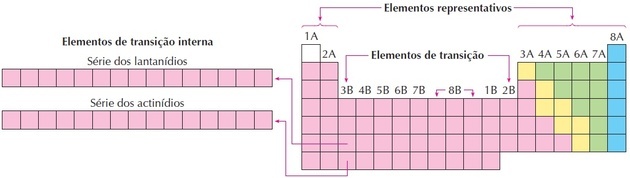
Як ми бачимо на зображенні, сімейство 8B відповідає 3 стовпцям, це групи 8, 9 і 10, які були згруповані так, оскільки вони мають подібні характеристики.
Основні характеристики сімей
У таблиці нижче наведені основні властивості груп у періодичній системі:
| Група | Особливості | складні речовини частіше |
випадки |
|---|---|---|---|
| 1 | Твердий і блискучий в навколишніх умовах. Дуже реактивний, м’який і хороший провідник електрики. | Солі, гідроксиди та оксиди |
Реагує з галогенами та утворює солі. |
| 2 | Менш реактивний і важчий, ніж група 1. Тверді речовини срібла з хорошою провідністю. | Солі, гідроксиди та оксиди |
Утворюючи солі та оксиди. |
| 3 - 12 | Вони утворюють комплекси. Вони являють собою тверді металеві тверді речовини, тверді та крихкі, за винятком ртуті, яка є рідиною. | Солі, оксиди та комплекси. Приклад: AgNO3, TiO та [Cr (OH)3(H2O)3] |
У мінералах у формі оксидів. |
| 13 | Тверді речовини в умовах навколишнього середовища, срібло, крім бору. | Оксиди Приклад: B2О3 |
У мінералах у формі оксидів. |
| 14 | Твердий в умовах навколишнього середовища. | Атоми С і Si можуть розташовуватися в ланцюгах і утворювати величезну кількість різноманітних речовин. | У живих організмах і у формі силікатів або оксидів. |
| 15 | Тверді речовини, крім азоту, який є газоподібним за умов навколишнього середовища. | Оксиди та кислоти Приклад: НІ2 та H3ПИЛ4 |
Атмосфера, живі організми та мінерали. |
| 16 | Тверді речовини, крім кисню, який є газоподібним за умов навколишнього середовища. | Сульфіди та оксиди Приклад: ZnS і SiO2 |
Атмосфера, живі організми та мінерали. |
| 17 | Вони утворюють двоатомні молекули і дуже реактивні. Вони погані провідники електрики та тепла. Вони агресивні до живих істот та навколишнього середовища. | Кислоти та солі. Наприклад: HCl і KBr |
Є в речовинах органічні та мінеральні. |
| 18 | Вони дуже стійкі і містяться у вигляді газів. | Вони майже не утворюють складних речовин. | Гази в атмосфері. |
Хімічні та фізичні властивості відрізняють одне сімейство від іншого. Як ми бачили, хімічні властивості пов'язані з електрони валентності, а через них атом взаємодіє з іншим, відповідаючи за хімічну поведінку і хімічні зв’язки сформований.
Фізичні властивості елементів однієї групи можуть змінюватися залежно від атомного номера та маси.
Вправи
Тепер, коли ви знаєте трохи більше про сім'ї Періодичної системи, перевірте свої знання та перевірте, що ви дізналися.
1) Розгляньте наступний витяг з Періодичної системи.
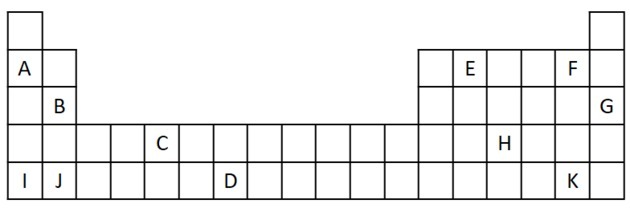
а) Назвіть два елементи, які мають два валентні електрони.
б) Вкажіть елемент, який бурхливо реагує з водою, утворюючи гідроксид металу.
в) Вкажіть нереактивний елемент.
г) Вкажіть два елементи, які поєднуються з лужними металами з утворенням солей.
Відповідь:
а) B і J
Два валентні електрони відповідають групі 2, яка має ns-електронну конфігурацію2 і представлені у вправі B та J.
б) A, B, I або J.
A і I представляють елементи сім'ї 1; B і J - з родини 2. Як ми побачили в таблиці властивостей, елементи 1 та 2 дуже реакційноздатні і можуть утворювати гідроксиди, як у наведених прикладах: KOH та Mg (OH)2.
в) Г
Шляхетні гази дуже стабільні і тому не дуже реактивні. Буква G вставляється в таблицю як елемент цього сімейства.
г) F і K
Галогени реагують з лужними металами, утворюючи солі. Найпоширенішим прикладом цього є кухонна сіль, NaCl.
2) На наступному малюнку показано три хімічні елементи, ліворуч - праворуч, літій, натрій та калій.

Виберіть варіант, який правильно заповнює кожне з наступних тверджень.
1.1) "Можна сказати, що літій, натрій і калій ...
(А)... належать до того самого періоду ".
(B)... має однаковий атомний номер ".
(C)... належать до однієї групи ".
(D)... має однакове масове число ".
1.2) "Елементи літію, натрію та калію ...
(A)... має дуже схожі хімічні властивості ".
(B)... має дуже різні хімічні властивості ".
(C)... - це неметали. "
(D)... реагувати з водою, утворюючи кислі розчини ".
Відповіді:
1.1) (С) належать до тієї самої групи.
1.2) (А) має дуже подібні хімічні властивості.
Ми можемо отримати цю інформацію, проконсультувавшись з періодичною системою або здійснивши електронний розподіл елементів літію, натрію та калію. Ми побачимо, що ці троє мають електрон у валентній оболонці, і оскільки вони входять до однієї групи, хімічні властивості дуже схожі.
3) Розглянемо наступну таблицю, де представлені атомні числа та електронні розподіли деяких хімічних елементів.
| Стихія | хімічний символ | атомний номер | Елетронний розподіл |
|---|---|---|---|
| Літій | читати | 3 | 2,1 |
| Берилій | бути | 4 | 2,2 |
| Фтор | F | 9 | 2,7 |
| неонові | Га | 10 | 2,8 |
| хлор | Кл | 17 | 2,8,7 |
| аргон | Повітря | 18 | 2,8,8 |
| Калій | К | 19 | 2,8,8,1 |
| Кальцій | Ось | 20 | 2,8,8,2 |
Вкажіть групу кожного елемента.
Відповідь:
Літій і калій: група 1. (Вони мають електрон у валентній оболонці).
Берилій та кальцій: група 2. (Вони мають два електрони у валентній оболонці).
Фтор і хлор: група 17. (Вони мають сім електронів у валентній оболонці).
Неон та аргон: група 18. (Вони мають вісім електронів у валентній оболонці).
Перевірте запитання на вступному іспиті з коментарем у Вправи на Періодичній системі та неопубліковані запитання з цього приводу в Вправи з упорядкування періодичної системи.



