Кипіння - це перехід з рідкого стану в газоподібний. Це трапляється, коли порція рідини, піддана певному тиску, отримує тепло і досягає певної температури.
Кількість тепла, яке організм повинен отримати, щоб повністю перетворитися на пару, залежить від речовини, яка його складає.
Речовина в рідкому стані не має визначеної форми, приймаючи форму контейнера, що її містить.
Будучи практично незрозумілим, він представляє силу зв’язку між частинками, що його складають.
Щоб перейти в газоподібний стан, речовина повинна отримувати тепло. Це збільшення енергії змусить молекули вібрувати з більшою інтенсивністю, збільшуючи відстань між ними.
Таким чином, когезійна сила практично не існує. Тіло в такому стані не має певної форми або обсягу.
Гейзери - приклади кипіння, яке відбувається з підземними водами, розташованими у вулканічних районах. Магма нагріває воду, і коли вона досягає певної температури, вона починає змінювати стан.
Пара займає більший об’єм, збільшуючи тиск у підземній порожнині. В результаті суміш пари та рідини викидається на поверхню через невеликі тріщини.

Характеристики кипіння
Рідина закипає за такою схемою:
- Підтримуючи постійний тиск, температура протягом усього процесу кипіння залишатиметься постійною.
- Кількість теплоти, що припадає на одиницю маси, необхідна для повного перетворення рідини у пару, називається прихованою теплотою випаровування. Його значення залежить від речовини, з якої складається рідина.
- Температура, при якій кожна речовина кипить, добре визначається і називається температурою кипіння.
Порада: Коли ми готуємо їжу, непогано включати вогонь, коли вода починає закипати. Оскільки температура залишається постійною протягом усього процесу кипіння, час готування буде однаковим при сильному нагріванні або слабкому нагріванні. Таким чином, ми економимо газ, і навколишнє середовище вдячне.
Кількість прихованого тепла
Кількість тепла, яке рідина повинна отримати для перетворення у пару, залежить від величини прихованої теплоти випаровування та її маси.
Нижче ми представляємо значення прихованої теплоти випаровування деяких речовин:

Формула
Для розрахунку кількості тепла, необхідного рідини для зміни стану, ми використовуємо таку формулу:
Де,
Питанняv: кількість тепла (вапно)
м: маса (г)
Lv: прихована теплота випаровування (кал / г)
Приклад:
Скільки тепла потрібно, щоб 100 г етанолу закипіло і повністю перетворилося на пару?
Питанняv = 100. 204 = 204000 кал
Температура кипіння
Температура, при якій тіло зазнає кипіння, залежить від речовини, що його складає, і тиску, на який воно зазнає.
Температура кипіння речовин визначається в лабораторії. Наприклад, температура кипіння води в атмосфері 1 становить 100 ° С. Залізо - 2800 ° C, тоді як водень - 252,8 ° C.
Щоб дізнатися температуру зміни фаз інших речовин, також прочитайте Точка кипіння.
Чим менше тиску піддається тіло, тим нижче температура його кипіння. Це означає, що у містах з великою висотою готування їжі займає набагато більше часу.
Для швидшого приготування їжі ми використовуємо скороварки. Цей тип плити використовує систему ущільнення, завдяки якій тиск усередині неї перевищує атмосферний.
Більш високий тиск також підвищує температуру кипіння. У випадку води вона закипить при температурі, яка може досягати 120 ºC, скорочуючи час приготування.
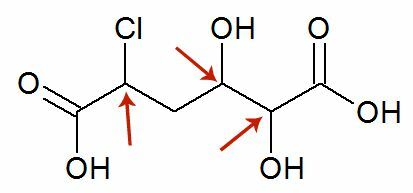
фазові зміни
Взагалі називається перехід від рідкого до газоподібного стану випаровування, оскільки він охоплює, окрім кипіння, ще два процеси: випаровування та опалення.
Випаровування відбувається поступово, не потрібно досягати певної температури. З іншого боку, нагрівання відбувається, коли ми розміщуємо рідину на поверхні, яка має температуру вище температури кипіння.
Ще існують інші процеси зміни стану. Чи вони:
- Злиття
- Затвердіння
- Зрідження або конденсація
- Сублімація
На діаграмі нижче ми представляємо три фізичні стани речовини та відповідні зміни стану:
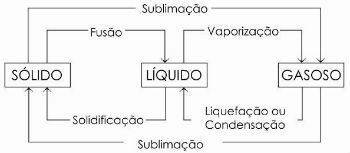
Щоб дізнатись більше, читайте теж Фізичний стан води.
Вправи
Енем - 1999 рік
Текст слід використовувати для наступних двох питань.
Скороварка дозволяє готувати їжу у воді набагато швидше, ніж звичайна плита. Його кришка має гумове ущільнення, яке не пропускає пар, за винятком центрального отвору, на якому лежить тягар, що контролює тиск. Під час використання всередині розвивається високий тиск. Для його безпечної експлуатації необхідно стежити за чистотою центрального отвору та існуванням запобіжного клапана, який зазвичай знаходиться в кришці.
Схема скороварки та діаграма водної фази представлені нижче.
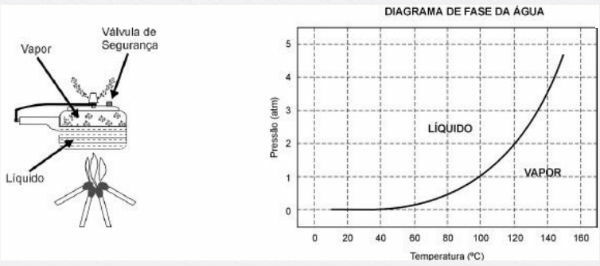
1) Перевага використання скороварки полягає в швидкості приготування їжі, і це пояснюється
а) тиск усередині нього, який дорівнює тиску зовні.
б) температура його внутрішньої частини, яка перевищує температуру кипіння води в цьому місці.
в) кількість додаткового тепла, яке передається на сковороду.
г) кількість пари, що виділяється клапаном.
д) товщина її стінки, яка більша, ніж у звичайних сковорідок.
Альтернатива b: при внутрішній температурі, яка перевищує температуру кипіння води в цьому місці.
2) Якщо для економії ми опускаємо тепло під скороваркою, як тільки пара виходить через клапан, щоб просто зберегти час кипіння, час варіння
а) вона буде більшою, тому що каструля «охолоджується».
б) буде меншим, оскільки зменшує втрати води.
в) буде більшим із зменшенням тиску.
г) буде більшим із зменшенням випаровування.
д) не зміниться, оскільки температура не змінюється.
Альтернатива e: не буде змінена, оскільки температура не змінюється.