Коли ми вимовляємо слово “баланс”, на думку спадає об’єкт, який залишається нескінченно довго. Однак це лише один вид балансу, який називається “Статична рівновага”.
Існує також “Динамічна рівновага”. У ньому, як сказано в назві, немає жодного моменту, коли б об’єкт чи явище, про яке йде мова, все ще знаходилось. Наприклад, щоб ви зрозуміли, дивіться ілюстрацію нижче і зауважте, що кількість води, яка потрапляє в контейнер, дорівнює кількості, яка витікає з нього, підтримуючи рівень води постійним. У такому випадку ми говоримо, що існує динамічний баланс, рівновага в русі.

Це такий баланс, який відбувається в оборотні реакції, тобто в тих реакціях, які відбуваються в обох напрямках. Одночасно, коли молекули реагентів перетворюються на продукти, молекули продуктів реагують між собою, утворюючи реагенти. Оборотність реакції представлена стрілками в обох напрямках:
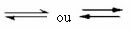
Коли швидкість розвитку прямої реакції (утворення продуктів) дорівнює швидкості розвитку зворотна реакція (утворення реагентів) при постійній температурі означає, що реакція досягла рівноваги хімічна.
А у випадку реакцій з наявністю лише молекул у реагентах та продуктах ми маємо a молекулярний баланс.Далі наведено приклад реакції, яка відбувається між газоподібним воднем (H2) та йоду (I2), для утворення газу йодистого водню (HI):
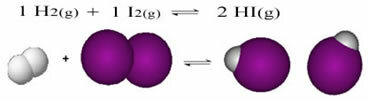
На початку реакції швидкість розвитку прямої реакції була вищою, адже концентрація реагентів була максимальною, а продуктів - нульовою. Тож швидкість розвитку зворотної реакції теж була нульовою.
Однак з часом гази водню та йоду реагують, утворюючи продукт. Таким чином, концентрація реагентів починає зменшуватися і швидкість їх розвитку також зменшується.
У міру збільшення концентрації продуктів і зменшення концентрації реагентів швидкість розвитку зворотної реакції починає зростати. Якщо температуру підтримувати постійною, настане момент, коли дві швидкості розвитку залишаться незмінними, таким чином показуючи, що реакція досягла хімічної молекулярної рівноваги.
Дженніфер Фогача
Закінчив хімію
Джерело: Бразильська школа - https://brasilescola.uol.com.br/quimica/equilibrio-molecular.htm


