Текст Титрування показав, як виконується ця техніка об'ємного аналізу, основною метою якої є визначити концентрацію розчину за його реакцією з іншим розчином відомої концентрації.
Тепер ми побачимо, як використовувати дані, отримані при титруванні, для досягнення бажаної концентрації, яка може бути кислотою або основою у розчині. Для цього є в основному три кроки:
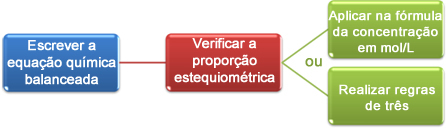
Давайте розглянемо приклад:
Скажімо, хімік мав розчин оцтової кислоти (оцту (СН3КУХ(тут))) і хотів з'ясувати його концентрацію в моль / л. Потім він помістив 20,0 мл оцту (титрованого) в колбу Ерленмейера і додав індикатор фенолфталеїну. Потім він заповнив 100 мл бюретки гідроксидом натрію (NaOH) з відомою концентрацією (титрантом), рівною 1,0 моль / л. Нарешті, хімік здійснив титрування і помітив, що зміна кольору (поворотний момент - коли він зупинив титрування) відбулася при споживанні 24 мл NaOH.

На основі цього експерименту він отримав такі дані:
МCH3COOH= ?
VCH3COOH = 20 мл = 0,02 л
МNaOH = 24 мл = 0,024 л
VNaOH = 1,0 моль / л
Де М = концентрація в моль / л, а V = об'єм в л.
Щоб з’ясувати концентрацію оцтової кислоти, спершу треба знати, як написати хімічне рівняння, яке представляє нейтралізуючу реакцію, яка відбулася належним чином збалансованою. У цьому випадку реакція наступна:
1 СН3КУХ(тут) + 1 NaOH(тут) → 1 NaC2H3О2 (вод.) + 1 година2О(ℓ)
Ця частина важлива, щоб побачити стехіометричне співвідношення, при якому реагують реагенти. Зверніть увагу, що співвідношення становить 1: 1, тобто на кожен моль оцтової кислоти потрібен 1 моль гідроксиду натрію.
Тепер ми можемо продовжувати обчислення двома способами:
(1-й) Через формулу: M1. V1 = М2. V2
Оскільки стехіометричне співвідношення дорівнює 1: 1, ми маємо: немаєCH3COOH = nNaOH .
Буття M = n / V → n = M. V. Таким чином, ми дійшли до наведеного вище списку, який у цьому випадку можна записати так: МCH3COOH. CH3COOH = МNaOH. VNaOH
Отже, просто замініть значення цієї формули:
МCH3COOH. V CH3COOH = МNaOH. VNaOH
МCH3COOH. 0,02 л = 1,0 моль / л. 0,024 л
МCH3COOH = 0,024 моль
0,02 л
МCH3COOH = 1,2 моль / л
Отже, початкова концентрація розчину оцтової кислоти, наша назва, була 1,2 моль / л.
Важлива примітка: Якби стехіометричне співвідношення не було 1: 1, було б достатньо помножити концентрацію речовин на моль / л (М) на їх відповідні коефіцієнти. Наприклад, якби співвідношення було 1: 2, ми мали б таке:
М1. V1 = 2. М2. V2
Але ось ще один спосіб виконати ці обчислення:
(2-е) Через правила трьох:
1 СН3КУХ(тут) + 1 NaOH(тут) → 1 СН3COONa(тут) + 1 година2О(ℓ)
1 моль 1 моль 1 моль 1 моль
1. 60г 1. 40 г 1. 82 г 1. 18 г.
Ці маси є розрахунковими молекулярними масами для кожної речовини.
* Знаючи, що витрачений об'єм 1,0 моль / л розчину NaOH(тут) становив 24 мл, ми можемо спочатку з’ясувати кількість речовини (моль) NaOH, яка реагувала:
1 моль NaOH → 1,0 л
1 моль NaOH 1000 мл
х 24 мл
x = 0,024 моль NaOH
* Оскільки співвідношення становить 1: 1, кількість речовини (моль) оцтової кислоти має бути таким же, як NaOH: 0,024 моль.
Спостереження: Якби стехіометричне відношення було іншим, ми б врахували це в цій частині. Наприклад, якби це було 1: 3, а кількість речовини в одному хімічно реагуючому виді дорівнювало 0,024 моль, тоді кількість іншої речовини було б потрійним: 0,072.
* Тепер розрахуємо:
20 мл оцту 0,024 моль оцтової кислоти
1000 мл оцту і
y = 1,2 моль
Тобто існує 1,2 моль / л, що є тим самим значенням, яке ми отримали в попередньому способі.
Дженніфер Фогача
Закінчив хімію
Джерело: Бразильська школа - https://brasilescola.uol.com.br/quimica/calculos-envolvidos-na-titulacao.htm
