Вуглеводні, також звані карбіди водню, є органічними сполуками, у складі яких є лише атоми вуглець (C) та від водень (H), маючи, таким чином, загальну формулу CхHр.
Вуглеводень складається з вуглецевої структури, до якої зв’язані атоми водню ковалентний зв’язок.
Це найважливіша сполука в органічній хімії.
Всі типи вуглеводнів легко окислюються, виділяючи тим самим тепло. Більшість з них не розчиняються у воді.
Природні вуглеводні - це хімічні сполуки, що утворюються всередині Землі (понад 150 км від глибини) при високому тиску і досягати зон нижчого тиску завдяки геологічним процесам.
Де знайдені вуглеводні?
Основним джерелом вуглеводнів є нафта. Через це вуглеводень присутній у кількох похідних, таких як гас, парафін, природний газ, Бензин, Вазелін, дизельне масло, LPG (Зріджений нафтовий газ), полімери (наприклад, пластик та гума), серед інших.
Ця органічна сполука становить 48% енергетичної матриці Бразилії.
Вуглецевий ланцюг, що входить до складу вуглеводню, є чотиривалентний, тобто він може встановити чотири з'єднання.
Вуглець здатний зв'язуватися з іншими атомами вуглецю та з воднями через прості посилання, вдвічі або потрійні.
Класифікація вуглеводнів
Класифікація вуглеводнів базується на трьох особливостях: a форму основного вуглецевого ланцюга, Зв'язки вуглецевих ланцюгів, наявність алкільних радикалів у вуглецевому ланцюзі і наявність гетероатомів поділ вуглецевого ланцюга.
знати більше про водень.
Основна форма вуглецевого ланцюга
Що стосується форми головного вуглецевого ланцюга, класифікація вуглеводнів поділяється на аліфатичний і циклічний.
Перевірте, з чого складається кожна з цих форм вуглецевого ланцюга.
аліфатичні вуглеводні
Аліфатичні вуглеводні утворені вуглецевими ланцюгами відчинено або ациклічні. У цих ланцюгах вуглець є терміналом.
Приклади:
алкан
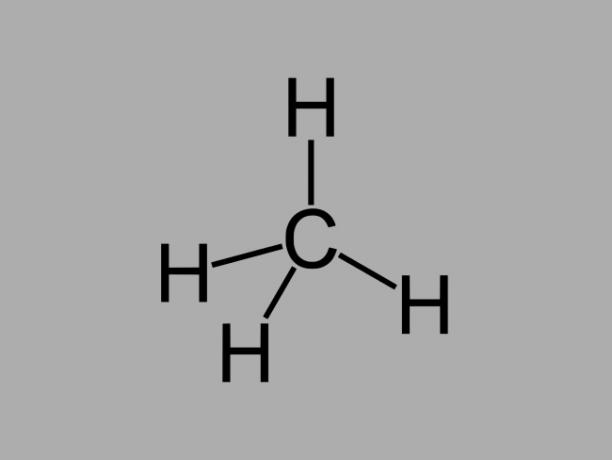
Алканові вуглеводні, також звані парафіни або парафіновий, є маслянистими сполуками, де між вуглецями існують лише одинарні зв’язки.
Загальною формулою алкану є СнемаєН2немає + 2 (n = будь-яке ціле число).
алкен
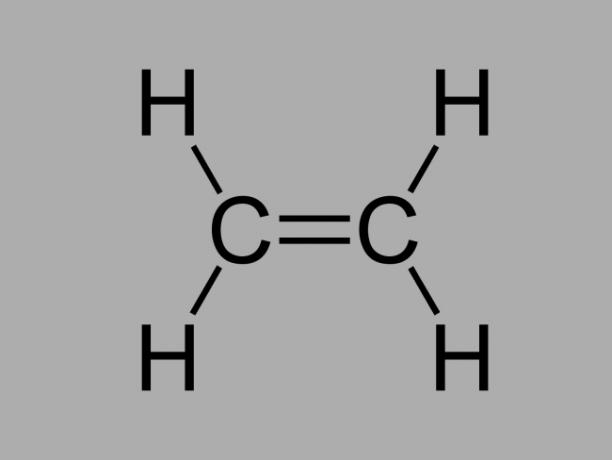
Також називається олефін, алкен або етиленовий вуглеводень, алкен є погано реакційноздатною сполукою, де між вуглецями існує подвійний зв’язок.
Загальною формулою алкену є СнемаєН2немає.
алкін
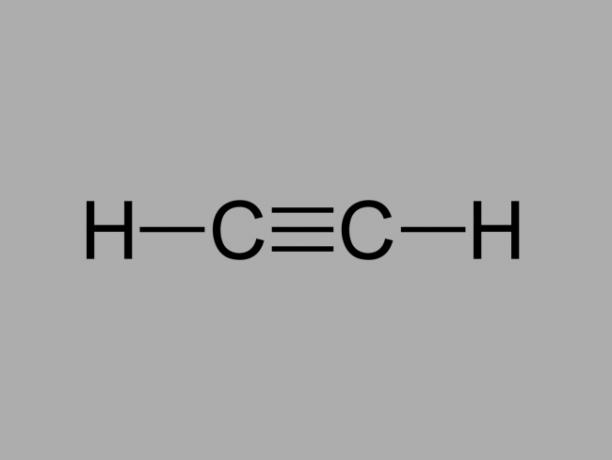
Також називається метилацетилен, алкін - вуглеводень, де існуючі зв’язки між вуглецями потрійні.
Загальною формулою алкіну є СнемаєН2немає-2.
алкадієн

Також алкадієни, які також називаються дієнами або діолефінами, є вуглеводнями, де зв’язки між вуглецями подвійні.
Загальною формулою алкадієну є СнемаєН2немає-2.
Циклічні вуглеводні
Циклічні вуглеводні утворені замкнутими або циклічними вуглецевими ланцюгами. Ці ланцюги не мають кінцевих вуглеців.
Приклади:
Циклан
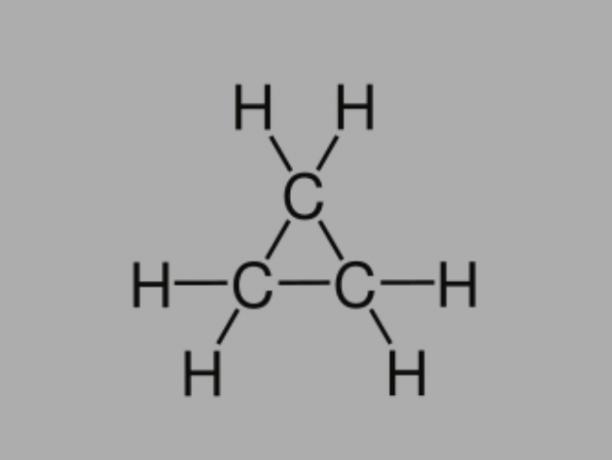
Також називається циклоалкан, циклопарафін або нафтеновий вуглеводень, циклан - насичений вуглеводень, що складається з одинарних зв’язків.
Він має замкнутий вуглецевий ланцюг і загальною формулою є СнемаєН2немає.
Циклонічна

Також називається циклоалкени, цикли - ненасичені вуглеводні, що складаються з подвійних зв’язків.
Цикл має замкнутий вуглецевий ланцюг і загальною формулою є СнемаєН2немає−2.
велосипедист
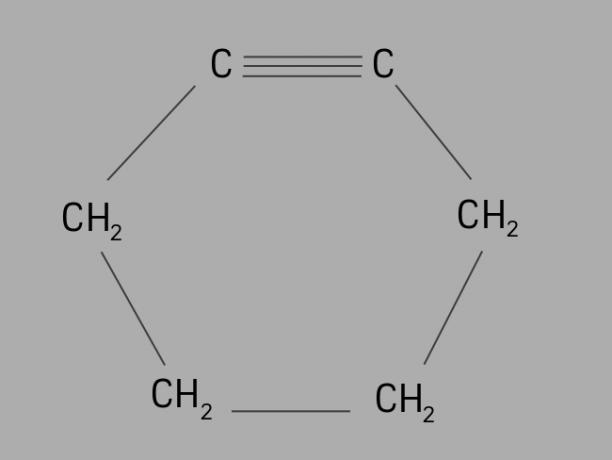
Також називається циклоалкін або циклоалкін, циклін - циклічний і ненасичений вуглеводень.
Він утворений замкнутим вуглецевим ланцюгом, з потрійними зв’язками, і загальною формулою є СнемаєН2немає-4.
Ароматичний

або

Також називається арени, ароматичні вуглеводні - ненасичені сполуки, утворені подвійними зв’язками.
Ароматичний має замкнутий або циклічний вуглецевий ланцюг і загальною формулою є С6H6.
Тип скріплення вуглецевих ланцюгів
Залежно від типу зв’язку вуглецевих ланцюгів вуглеводні можна класифікувати на насичений або ненасичений.
Подивіться нижче, з чого складається кожна з цих класифікацій.
Насичені вуглеводні
Насичені вуглеводні утворюються прості посилання.
Приклади: алкани, циклани.
ненасичені вуглеводні
Ненасичені вуглеводні утворюються подвійні зв'язки або потрійні.
Приклади: алкени, алкіни, алкадієни.
Наявність алкільних радикалів
Що стосується присутності алкільних радикалів, вуглеводні можуть мати вуглецевий ланцюг нормальний або розгалужений.
нормальний вуглецевий ланцюг
Звичайний вуглеводень вуглецевого ланцюга не має алкільних радикалів.
Приклад: пентан
розгалужений вуглецевий ланцюг
Коли вуглеводень має розгалужений вуглецевий ланцюг, це означає, що його основний вуглецевий ланцюг має алкільні радикали.
Приклад: метилпропан
Наявність гетероатомів, що розділяють вуглецевий ланцюг
Послідовний вуглецевий ланцюг може бути роздвоєний або не роздільний залежно від наявності гетероатомів.
Однорідний вуглецевий ланцюг
Коли вуглеводень має однорідний основний вуглецевий ланцюг, це означає, що цей ланцюг не ділиться гетероатомами.
Неоднорідний вуглецевий ланцюг
Якщо вуглеводень має неоднорідний основний вуглецевий ланцюг, цей ланцюг мав свої розщеплений вуглецевий ланцюг гетероатомом.
Номенклатура вуглеводнів
Номенклатура вуглеводнів визначається поєднанням трьох частин:

Префікс визначає кількість вуглецю, проміжний - тип зв'язку, а суфікс - функцію, до якої належить сполука (в даному випадку клас вуглеводнів).
Нижче наведено перелік приставок та проміжних сполук, які поєднуються для позначення вуглеводнів.
Список префіксів
| Кількість вуглеців | Префікс |
|---|---|
| 1 | Met- |
| 2 | Et- |
| 3 | Проп- |
| 4 | Але- |
| 5 | пент- |
| 6 | Шістнадцятковий |
| 7 | Hept- |
| 8 | Жовтень- |
| 9 | Не- |
| 10 | Грудня |
Список посередників
| Тип підключення | Посередник |
|---|---|
| Лише поодинокі дзвінки | -an- |
| Пара | -en- |
| потрійний | -в- |
| дві пари | -дієн- |
Погляньте на кілька прикладів іменування вуглеводнів.
Приклади:
СН3 - СН2 - СН2 - СН3
У наведеній вище структурній формі ми можемо побачити 4-вуглецеву сполуку, яка має лише одинарні зв’язки (позначена символом «-»).
- Префікс для 4 атомів = але-
- Проміжний продукт для одноразового зв'язування = -an-
- Суфікс вуглеводню = -o
Дивіться, що союз префікс + проміжний + суфікс породжує назву БУТАН.
СН2 = СН2
Структурна форма, наведена вище, має 2 вуглеці та 1 подвійний зв’язок (позначений символом “=”).
- Префікс для 2 атомів = et-
- Проміжний для подвійних облігацій = -en-
- Суфікс вуглеводню = -o
Дивіться, що союз префікс + проміжний + суфікс породжує назву ЕФЕН.
СН2 = СН - СН2 - СН3
СН3 - СН = СН2 - СН3
Зверніть увагу, що обидві вищезазначені структурні форми мають 4 вуглецю та 1 подвійний зв’язок (позначений символом “=”).
Таким чином, ми маємо:
- Префікс для 4 атомів = але-
- Проміжний для подвійних облігацій = -en-
- Суфікс вуглеводню = -o
Дивіться, що союз префікс + проміжний + суфікс дало б назву БУТЕН для двох структурних форм.
Однак зауважте, що структурні форми не є ідентичними, тому номенклатури не можуть бути такими.
Різниця між двома структурними формами полягає в розташуванні подвійного зв'язку.
У цьому випадку ми повинні пронумерувати вуглець в ланцюзі від кінця, найближчого до подвійного. Отже, у розглянутих випадках ми повинні нумерувати зліва направо.
В СН2 = СН - СН2 - СН3:
- СН2 буде 1
- СН буде 2
- СН2 буде 3
- СН3 буде 4
Зверніть увагу, що подвійний зв’язок знаходиться між вуглець 1 це вуглець 2.
Ми повинні використовувати найменше число (1), щоб знайти подвійний зв’язок: БЮТЕН -1
В СН3 - СН = СН2 - СН3:
- СН3 буде 1
- СН буде 2
- СН2 буде 3
- СН3 буде 4
Зверніть увагу, що подвійний зв'язок знаходиться між вуглець 2 це вуглець 3.
Ми повинні використовувати найменше число (2), щоб знайти подвійний зв’язок: БУТЕН -2
Відповідно до IUPAC (Міжнародний союз чистої та прикладної хімії - Міжнародний союз чистої та прикладної хімії), місце розташування слід вказати трохи раніше розміщується (у випадку структурних формалів, наведених вище, подвійний зв’язок, представлений проміжним “-En-”).
Зважаючи на це, ми маємо другий спосіб, який, до речі, є найбільш правильним, написання номенклатури наявних структурних форм.
СН2 = СН - СН2 - СН3: BUTENE -1 або BUT-1-ENO (більш правильна форма)
СН3 - СН = СН2 - СН3: BUTENE -2 або BUT-2-ENE (більш правильна форма)
Дізнайтеся більше про IUPAC і номенклатура.
