валентний шар це самий зовнішній шар (або рівень) (найдальший від ядра) атома, тобто найдальший від ядра. Тому в ньому є так звані зовнішні електрони або валентні електрони.
Кількість рівнів, які може мати атом, варіюється від 1 до 7, які мають такі підрівні (жовтим кольором):
рівень К (1-й шар): підрівень s
рівень L (2-й шар): підрівні s і P
рівень М (3-й шар): підрівні s, P і d
рівень N (4-й шар): підрівні s, P, d і f
рівень O (5-й рівень): підрівні s, P, d і f
Рівень Р (6-й рівень): підрівні s, P і d
рівень Q (1-й шар): підрівні s і P
Кожен з підрівнів містить різну кількість електронів. Подивіться:
підрівень s вміщує максимум 2 електрони;
підрівень p вміщує максимум 6 електронів;
підрівень d містить максимум 10 електронів;
підрівень f вміщує максимум 14 електронів.
Таким чином, якщо валентна оболонка певного атома дорівнює М, максимальна кількість електронів, яка може в ньому можуть бути 18 (2 електрони від s-рівня + 6 електронів від p-рівня + 10 електронів від підрівень г).
Визначити валентну оболонку атома і скільки в ній електронів є двома способами, а саме:
→ Визначення валентної оболонки та її кількості електронів від електронного розподілу
Електронне розповсюдження завжди здійснюється через Діаграма Лінуса Полінга, представлені нижче:

Представлення діаграми Лінуса Полінга
Звичайний атомний номер (що вказує на кількість електронів в атомі), ми робимо електронний розподіл. Наприклад, атом з атомним номером 50:

Електронний розподіл атома з атомним номером дорівнює 50
Аналізуючи вищезазначений розподіл, ми маємо, що найвіддаленіший від ядра рівень - це 5-й (рівень N), в якому ми маємо присутність 4 електронів (два в s підрівні і 2 в p підрівні).
→ Визначення валентної оболонки та її кількості електронів з Періодичної системи
Таблиця розташована за періодами (горизонтальні стовпці), які вказують кількість рівнів атома, та групи або сімейства (вертикальні стовпці). Період використовується для визначення валентний шар, а сімейства використовуються для визначення кількості електронів.
а) Знання періоду дії хімічного елемента
У Періодичній системі представлено загалом сім періодів, кількість яких пов’язана з кількістю рівнів, присутніх на діаграмі Лінуса Полінга. Отже, якщо ми знаємо період, в який хімічний елемент це в таблиці, ми автоматично знаємо, скільки рівнів мають ваші атоми, причому валентний шар є найвіддаленішим від ядра.
1-й приклад: хімічний елемент Калій
Калій позиціонується в четвертому періоді Періодичної системи, тому його атом має чотири рівнів, четвертим рівнем є валентний шар, що підтверджується його розподілом електроніки.
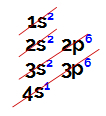
Електронний розподіл елемента калію
2-й приклад: хімічний елемент Фтор
Фтор розміщений у другому періоді Періодичної системи, тому його атом має два рівнів, другий рівень - це валентний шар, що підтверджується його розподілом електроніки.

Електронний розподіл елементу фтору
3-й приклад: хімічний елемент індію
Не зупиняйтесь зараз... Після реклами є ще щось;)
Індіанець розміщений у п’ятому періоді Періодичної системи, тому його атом має п’ять рівнів, п’ятим рівнем є валентний шар, що підтверджується його розподілом електроніки.

Електронний розподіл елементу Індій
б) Знання родини або групи хімічного елемента
Знаючи сім'ю або групу, в якій розташований елемент, ми також знаємо кількість електронів, що знаходяться у валентній оболонці цього елемента.
Елементи сім'ї А
Елементи сімей A розміщені у стовпцях 1, 2, 13 - 18 Періодичної системи. Кожен із цих стовпців отримує число (від 1 до 8, римські цифри), яке вказує точно кількість електронів у валентній оболонці цих елементів:
Стовпець 1 - сімейство IA = всі мають 1 електрон у валентній оболонці;
Стовпець 2 - сімейство IIA = всі мають 2 електрони у валентній оболонці;
Стовпець 3 - сімейство IIIA = всі мають 3 електрони у валентній оболонці;
Стовпець 4 - сімейство IVA = всі мають 4 електрони у валентній оболонці;
Стовпець 5 - сімейство VA = всі мають 5 електронів у валентній оболонці;
Стовпець 6 - сімейство VIA = всі мають 6 електронів у валентній оболонці;
Стовпець 7 - сімейство VIIA = всі мають 7 електронів у валентній оболонці;
Стовпець 8 - сімейство VIIIA = всі мають 8 електронів у валентній оболонці.
Див. Кілька прикладів визначення числа валентних електронів деяких елементів сімейства A:
Приклад 1: хімічний елемент барій
Барій знаходиться в сімействі IIA, тому він має два електрони у валентній оболонці, що підтверджується його електронним розподілом:

Електронний розподіл елементу барію
Приклад 2: Сурма хімічний елемент
Сурма знаходиться у сімействі VA, тому вона має п’ять електронів у валентній оболонці, що підтверджується її електронним розподілом:

Електронний розподіл елементу сурми
Приклад 3: Хімічний елемент ксенону
Ксенон знаходиться в сім’ї VIIIA, тому він має вісім електронів у валентній оболонці, що підтверджується його електронним розподілом.

Електронний розподіл ксенонового елемента
ПРИМІТКА: єдиним хімічним елементом, що належить до сімейства A, який не відповідає запропонованому правилу, є гелій. Він належить до сімейства VIIIA, але має лише два електрони у валентній оболонці. Це пов’язано з тим, що його атомний номер дорівнює 2, тому йому неможливо мати 8 електронів у валентній оболонці, як інші елементи сімейства.
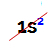
Електронний розподіл атома гелію
Елементи сім'ї B
Елементи сімей B розміщені у стовпцях 3 - 12 Періодичної системи. Окрім сімей A, існує також вісім сімей B, які представлені римськими цифрами. На відміну від сімейств A, число сімейства B не визначає кількість електронів у валентній оболонці.
Кількість електронів у валентній оболонці елемента сімейства B завжди дорівнює 2, незалежно від атомного номера та положення в таблиці. Електронні дистрибутиви каліфорнію (98Пор.) І hassius (108hs) доведіть це:
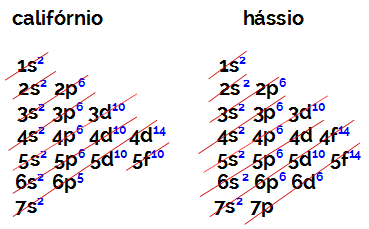
Електронний розподіл каліфорнію має найбільш енергійним підрівнем 5f10, а o hassius - 6d6. В обох випадках найнижчий від ядра підрівень - сьомий рівень, і в обох є два розподілені електрони.
Мені Діого Лопес Діас