Французький хімік Джозеф Луї Пруст (1754-1826) продовжував проводити ретельні експерименти, що стосувались маси компонентів певних реакцій.
Наприклад, елементами, з яких складається вода, є водень і кисень. Пруст виявив, що в цій водоутворюючій реакції водень завжди реагував з киснем у постійному і визначеному співвідношенні, яке становило 1: 8 відповідно. Подивіться, як це відбувається нижче:

Зверніть увагу на це незалежно від того, яка маса використовуваних елементів, пропорція завжди буде однаковою.
Пруст зазначив, що це стосувалося не лише води, а й усіх інших речовин.
15,06 г сульфіду міді (CuS) утворюється, наприклад, при взаємодії 10,00 г металевої міді (Cu) з 5,06 г сірки (S). Отже, якщо ми подвоїмо кількість міді (яка складе 20,0 г), і якщо ми хочемо, щоб вся мідь реагувала, також потрібно буде подвоїти кількість сірки, до 10,12 г, із загальним утворенням 30,12 г сульфід.
Тепер, якщо додати суму, яка не пропорційна, зайва сума залишиться, вона не зреагує. Зверніть увагу на це нижче:
Не зупиняйтесь зараз... Після реклами є ще щось;)
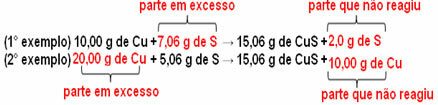
Зверніть увагу на це реакція відбувається лише відповідно до визначеної пропорції. Тому в 1799 р. Пруст дійшов висновку, що, коли кілька речовин поєднуються, утворюючи сполуку, це завжди робиться за певного масового співвідношення.
Тож він створив Закон, який називається Закон Пруста, Закон постійних пропорцій або Закон визначених пропорцій, що викладено таким чином:

Цей закон і Закон Лавуазьє (Закон про збереження маси) названі Закони про вагу, оскільки вони говорять масою речовин, що беруть участь.
Дженніфер Фогача
Закінчив хімію
Хотіли б ви посилатися на цей текст у школі чи академічній роботі? Подивіться:
FOGAÇA, Дженніфер Роша Варгас. «Закон Пруста або Закон постійних пропорцій»; Бразильська школа. Доступно: https://brasilescola.uol.com.br/quimica/lei-proust-ou-lei-das-proporcoes-constantes.htm. Доступ 27 червня 2021 року.



