Кожна клітина - це пристрій, в якому відбувається спонтанна реакція окислення-відновлення, яка генерує електричний струм, який, у свою чергу, використовується для роботи деякого обладнання.
Свою назву ці пристрої отримали тому, що першу створену батарею винайшов Алессандро Ще в 1800 році він був утворений цинковими та мідними дисками, розділеними змоченою бавовною розсіл. Цей комплект був розміщений впереміш, один на інший, нагромадження дисків і утворює велику колону. Як було акумулятор дисків, стали називатися цим ім'ям.

Акумулятори завжди складаються з двох електродів та електроліту. Позитивний електрод називається а катод і тут реакція скорочення. Від'ємним електродом є анод і тут реакція окислення. Електроліт ще називають сольовий міст і є іонопровідним розчином.
Щоб ви зрозуміли, як це генерує електричний струм, див. Приклад однієї з перших батарей, Купа Даніеля, в якому знаходилася ємність з розчином сульфату міді (CuSO4 (вод.)) і, занурений у цей розчин, являв собою мідну пластину. В іншому окремому контейнері знаходився розчин сульфату цинку (ZnSO
4 (вод.)) і опущена цинкова пластина. Два розчини були з'єднані сольовим містком, який представляв собою скляну трубку з розчином сульфату калію (K2ТІЛЬКИ4 (вод.)) зі скловата на кінцях. Нарешті, дві пластини були з’єднані зовнішнім ланцюгом із лампою, освітлення якої означало б проходження електричного струму: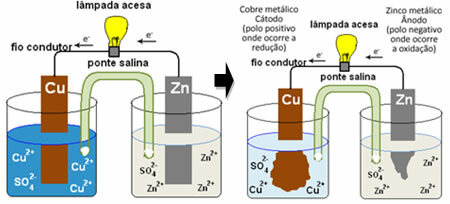
Що відбувається, так це те, що цинк має більшу тенденцію до окислення, тобто до втрати електронів, тому металевий цинк леза працює як негативний електрод, анод, де відбувається окислення: Zn(s) ↔ Zn2+(тут) + 2 і-. Електрони, втрачені цинком, передаються зовнішнім ланцюгом до міді, генеруючи електричний струм, який включає лампу. Іони міді в розчині отримують електрони (відновлюються) і перетворюються в металеву мідь, яка осідає на мідному листі. Це означає, що це позитивний електрод, катод, де відбувається відновлення: Дупу2+(тут) + 2 і- ↔ жопа(s).
Не зупиняйтесь зараз... Після реклами є ще щось;)
У сучасних батареях діє той самий принцип роботи, коли один метал віддає електрони іншому через провідний розчин і виробляється електричний струм. Різниця полягає в тому, що батареї, що використовуються сьогодні, сухі, оскільки вони не використовують рідкий розчин як електроліт, як це відбувається в батареї Даніеля.
На сьогоднішній день існує дуже широкий вибір батарей, які продаються в комерційних цілях. Серед них найпоширенішими є кислотні клітини (від Leclanché) таалкалінові батареї.
В обох негативним електродом є цинк; з іншого боку, як позитивний полюс, посередині купи встановлений графітовий брусок, оточений діоксидом марганцю (MnO2), порошкоподібне вугілля (С) та волога паста. Різниця полягає в тому, що в кислій кислоті хлорид амонію (NH) використовується у вологій пасті.4Cl) і хлорид цинку (ZnCl2) - кислі солі - крім води (H2О). У лужній батареї використовується гідроксид калію (КОН), який є основою.

Акумулятори Leclanché найкраще підходять для обладнання, яке вимагає легкого і постійного розряду, наприклад, пульта дистанційного керування, настінного годинника, портативного радіоприймача та іграшок. Лужні батареї, навпаки, мають на 50-100% більше енергії, ніж звичайні батареї того ж розміру, що рекомендується для обладнання, яке вимагають більш швидких та інтенсивних завантажень, таких як радіо, програвачі CD / DVD, портативні MP3-файли, ліхтарики, цифрові фотоапарати тощо

Дізнайтеся більше про те, які електроліти та електроди використовуються також у цих та інших типах акумуляторів. що стосується того, які типи обладнання вони рекомендують, читайте відповідні статті далі нижче.
Дженніфер Фогача
Закінчив хімію