Може трапитися так, що є кислоти одного і того ж елемента, і цей елемент має однакове окисне число (NOX), але різниця полягає в ступенях гідратації.
Наприклад, нижче ми маємо три кислоти, утворені елементом фосфор (P):
H3ПИЛ4 H4P2О7 HPO3
Зверніть увагу, що у всіх трьох кислотах окисне число фосфору становить +5; різниця полягає в ступені гідратації.
Виходячи з цього, ці кислоти диференціюються в номенклатурі за допомогою префіксів орто, піро та мета.
Найбільш гідратована кислота називається орто. У наведеному прикладі перший (H3ПИЛ4) це називається кислота ортофосфорний, оскільки він є найбільш гідратованим із трьох. Префікс орто є витратним, тому більшу частину цієї кислоти просто називатимуть фосфорна кислота.
Префікси pyro та meta використовуються з ортокислотою як орієнтиром:
Не зупиняйтесь зараз... Після реклами є ще щось;)
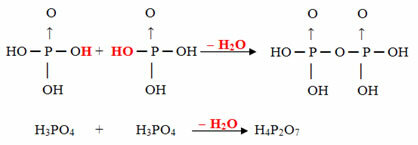
- Пірус: 2 молекули орто мінус 1 молекула Н2О
Приклад: H4P2О7 це називається кислота пірофосфорний оскільки він дорівнює двом молекулам ортофосфорної кислоти (Н3ПИЛ4) мінус одна молекула води.
2. H3ПИЛ4 = H6P2О8
H6P2О8 - Ч.2O = H4P2О7
Цей процес є міжмолекулярна дегідратація:
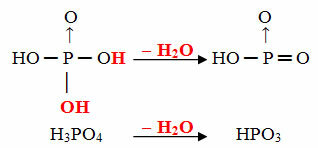
- Мета: 1 молекула орто мінус 1 молекула Н2О
Приклад: HPO3 це називається кислота метафосфорний оскільки вона дорівнює молекулі ортофосфорної кислоти (Н3ПИЛ4) мінус одна молекула води.
H3ПИЛ4 - Ч.2O = HPO3
Цей процес є внутрішньомолекулярна дегідратація:
Дженніфер Фогача
Закінчив хімію
Хотіли б ви посилатися на цей текст у школі чи академічній роботі? Подивіться:
FOGAÇA, Дженніфер Роша Варгас. «Ступінь гідратації кислот»; Бразильська школа. Доступно: https://brasilescola.uol.com.br/quimica/grau-hidratacao-dos-acidos.htm. Доступ 28 червня 2021 року.
Ортофосфорна кислота має таку молекулярну формулу: H3ПИЛ4. Звідти позначте альтернативу, яка позначає пірофосфорну кислоту та метафосфорну кислоту відповідно:
Ступінь іонізації, соляна кислота, летючість, оцтова кислота, Сванте Арреніус, кислоти, що проводять електроенергію, реакції нейтралізації, Реакція з карбонатами та бікарбонатами, розчин червоного фенолфталеїну, лакмусовий папір блакитний.

