Акумулятор це система, в якій хімічна енергія спонтанно перетворюється на електричну.
У 1836 році англійський хімік і метеоролог Джон Фредерік Данієл (1790-1845) побудував купу, відмінну від відомої на той час: купу Алессандро Вольта. У цій купі він з'єднані між собою двома електродами, які являли собою системи, що складаються з металу, зануреного у водний розчин солі, утвореної катіонами цього металу.
Один з електродів, мідний електрод, складався з мідної пластини, змоченої в розчині сульфату міді (CuSO4). Іншим електродом був цинковий електрод, що складався з цинкової пластини, зануреної в розчин сульфату цинку (ZnSO4).
Ці два електроди були з’єднані між собою електричним ланцюгом, який містив лампу, оскільки, якщо вона увімкнеться, це буде свідчити про появу електричного струму.
Також між ними був соляний міст. Цей місток складався з U-подібної скляної трубки, що містить концентрований водний розчин високорозчинної солі, наприклад, хлористого калію (KCl (aq)), наприклад. Кінці трубки покриті бавовною або агаром.
Нижче ми маємо будову цієї клітини або електрохімічної клітини, яка стала відомою як клітина Даніелла. Пам'ятаючи, що кожен електрод називається напівклітиною.
При замиканні ланцюга лампа вмикається і через деякий час, цинкова пластина піддається корозії та зменшує її масу, тоді як мідна пластина - навпаки, її маса збільшується (як показано на малюнку нижче). Також зазначається, що спостерігається збільшення концентрації в моль / л іонів Zn2+ і зменшення іонів Cu2+.
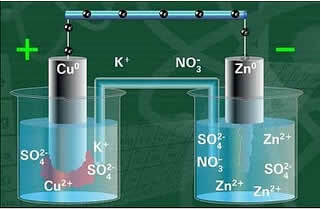
Схема стеку Даніелла.
Чому це відбувається?
Не зупиняйтесь зараз... Після реклами є ще щось;)
Щоб зрозуміти, давайте розглянемо реакції, що відбуваються на кожному електроді окремо.
В цинковому електроді відбувається така рівноважна реакція:
Zn (s) ↔ Zn2+(тут) + 2 і-
Це означає, що металевий цинк (з пластини) зазнає окислення, тобто він віддає два електрони в катіон цинку (з розчину) і стає Zn2 +. Також відбувається навпаки, катіон цинку, присутній у розчині, отримує два електрони, віддані цинком, і стає металевим цинком. Отже, відбувається безперервний процес окислення та відновлення.
Те саме стосується мідного електрода, який матиме глобальну реакцію в динамічній рівновазі: Cu (s) ↔ Cu2+(тут) + 2 і-
Даніелл зрозумів, що якщо він з'єднає ці два електроди, то більш реактивний віддасть свої електрони менш реактивному катіону, замість того, щоб робити це з катіонами у власному розчині. У цьому випадку цинк є найбільш реакційноздатним і зазнає окислення, віддаючи електрони міді, звідси зменшується його маса. Електрод, який зазнає окислення, є негативним полюсом, який називається анодом. Мідний електрод зазнає відновлення, катіон міді отримує два електрони з цинку і називається катодом (позитивним полюсом).
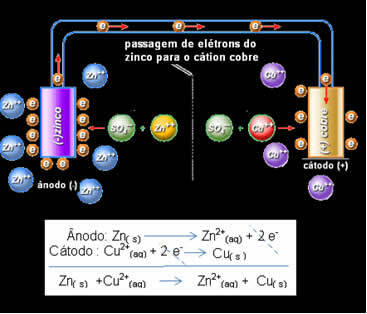
Електронний прохід і глобальне рівняння стека Даніелла.
Вище ми маємо глобальне рівняння для цього стеку, яке отримуємо додаванням двох напівреакцій. Його подання або хімічне позначення складається згідно з наступним правилом:

Отже, для стека Даніеля ми маємо:
Zn / Zn2+// Зад2+ / зад
Дженніфер Фогача
Закінчив хімію
Шкільна команда Бразилії
Фізико-хімічна - Хімія - Бразильська школа
Хотіли б ви посилатися на цей текст у школі чи академічній роботі? Подивіться:
FOGAÇA, Дженніфер Роша Варгас. «Куча Данила»; Бразильська школа. Доступно: https://brasilescola.uol.com.br/quimica/pilha-daniell.htm. Доступ 28 червня 2021 року.


