Ферменти є біологічними каталізаторами, відповідальними за збільшення швидкості даної хімічної реакції. Ферменти зазвичай є білки, але є деякі рибонуклеїнові кислоти які діють як ферменти, називаючись рибозимами.
Для прискорення реакції ферменти повинні зв’язуватися з реагентами, які відомі як субстрати. Довгий час вважалося, що це посилання відбувається дуже жорстко, за схемою, відомою як замок клавіш. на даний момент, Однак, прийнята модель, відома як індукований фітинг., який передбачає, що незначні зміни відбуваються у формі ферменту, коли субстрат потрапляє в активний центр.
Читайте також: Що таке метаболізм?
Що таке ферменти?
Ферменти - це біомолекули, які діють як каталізатори, тобто вони є речовини, здатні прискорювати швидкість хімічні реакції які трапляються у живих істот, не потрапляючи під час цих реакцій. Без дії ферментів деякі реакції були б дуже повільними, що шкодило б метаболізму. Ферменти вибірково прискорюють реакції і тому є дуже специфічними каталізаторами.
Ферменти здатні пришвидшити реакцію, зменшуючи енергію активації, тобто зменшують кількість енергії, яку потрібно додати, щоб почалася реакція.
[публікація_omnia]
Чи кожен фермент є білком?
Хоча їх часто визначають як біологічні каталізатори білкової природи, не кожен фермент є білком. Є деякі РНК, які функціонують як ферменти, які називаються рибозимами. Більшість ферментів, проте, є білками, утворюючись, отже, шляхом амінокислоти. Амінокислотний склад цих біомолекул визначає тривимірну структуру, яку він набуде.
Читайте також: Як діють каталітичні речовини?
Ферментно-субстратний комплекс
Його називають реагентним субстратом, на який діє фермент. Коли фермент зв'язується зі своїм субстратом, утворюється комплекс фермент-субстрат. Це зв'язування відбувається в певному регіоні, який називається активним сайтом.
Коли ми говоримо про ферменти на основі білка, активний центр відповідає лише декільком амінокислотам, а решта молекули відповідає за конфігурацію активного центру. Форма активного центру, а також форма субстрату пов'язані зі специфічністю ферменту, оскільки вони повинні доповнювати один одного.
Модель замка ключа
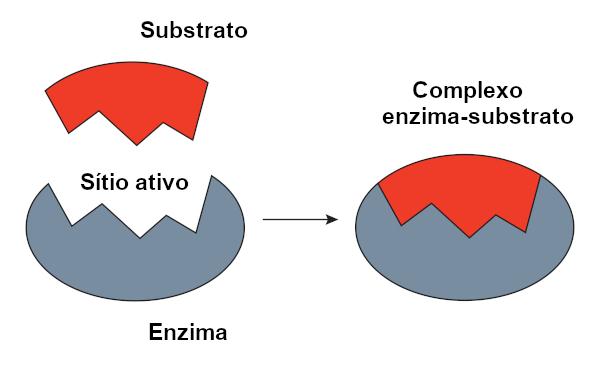
О модель блокування ключів, запропонована Емілем Фішером, широко використовується для пояснення взаємодії між ферментом та субстратом. Відповідно до цієї моделі між ферментом і субстратом існує жорстка взаємодоповнюваність, як ключ і замок. Активний сайт ферменту мав би комплементарну до субстрату форму, яка б ідеально підходила. Отже, інші молекули не мали б доступу до цього місця, що гарантувало б специфічність ферменту. Так само, як ключ відкриває лише замок, фермент зв'язується лише з субстратом. Однак сьогодні ми знаємо, що це модель неправильна, оскільки ферменти не є жорсткими структурами, як вважали раніше.
Індукована модель примірки
В даний час найбільш прийнята модель для пояснення зв'язку між ферментом та його субстратом є одним із оснащення індуковані, спочатку запропоноване Koshland et al. Активна площадка і основа не працюють жорстко, як ключ і замок. Дослідження показують, що коли субстрат потрапляє в активний центр, фермент зазнає невелику модифікацію, що сприяє припасуванню активного центру до субстрату. Щоб краще зрозуміти цю модель, ми можемо розглядати взаємодію ферментів і субстратів як рукостискання, яке стає більш твердим після першого контакту.
Кофактори
Більшості ферментів потрібні допоміжні молекули для здійснення їх каталітичної дії, які називаються кофакторами. Кофактори можуть бути постійно прикріплені до ферменту або можуть бути слабо та оборотно прикріплені до субстрату. Вони також може бути неорганічним або органічним. Коли кофактори є органічними молекулами, їх називають коферменти.
Деякі вітаміни діють як коферменти, це, наприклад, рибофлавін, також відомий як вітамін В2. Як приклади неорганічних кофакторів можна згадати залізо та цинк в їх іонній формі.
Читайте також: Вітаміни B-комплексу - група вітамінів, які зазвичай діють як коферменти
Класифікація ферментів
Ферменти можна класифікувати на шість груп, використовуючи в якості критерію тип реакції, яку вони каталізують.
Оксидоредуктази: ферменти, пов'язані з реакціями оксирскорочення.
Трансферази: каталізують перенесення груп з однієї сполуки в іншу.
Гідролази: каталізують реакції гідролізу.
Зв'язки: діяти шляхом додавання груп до подвійних зв’язків або видалення груп, що утворюють подвійний зв’язок.
Ізомерази: каталізують реакції ізомеризації.
Посилання: ферменти, що викликають деградацію молекули АТФ, використовуючи енергію, що виділяється в цій реакції, для утворення нових сполук.
Не зупиняйтесь зараз... Після реклами є ще щось;)
Фактори, що регулюють активність ферментів
На активність ферменту впливають фактори, головними з яких є температура і рН. Температура, як правило, відіграє позитивну роль у хімічних реакціях, збільшуючи швидкість ферментативної реакції. Однак, коли температури збільшується вище оптимальних умов, швидкість реакції значно падає. Це пов’язано з тим, що спостерігається денатурація білків. Більшість людських ферментів мають оптимальну температуру від 35 до 40 ºC. На додаток до температури, рН це також впливає на ферментативну активність, і є також оптимальне значення. Для більшості ферментів оптимальне значення рН знаходиться в діапазоні від 6 до 8.
Автор Ванесса Сардінья дос Сантос
Вчитель біології