В міжмолекулярні сили є темою з хімії, яка, безумовно, може з’явитися в Національному іспиті середньої школи (І будь-який). Тому варто ознайомитися з основним змістом цієї теми в цій статті.
Визначення
міжмолекулярні сили це сили - різної інтенсивності (слабкі, середні чи сильні) - електростатичного притягання або зв’язки, встановлені між молекулами речовини, що підтримують союз між ними.
Види міжмолекулярних сил
The) Індукований дипол
І міжмолекулярна сила що відбувається між молекулами речовини з неполярною характеристикою. Це трапляється, наприклад, між молекулами таких речовин, як О2, H2, немає2, CO2, СН4.
Об'єднання між цими молекулами відбувається, коли між ними створюється диполь. Це трапляється, коли електрони однієї молекули витісняють електрони іншої, створюючи таким чином негативний і позитивний полюс, який переноситься з однієї молекули на іншу.
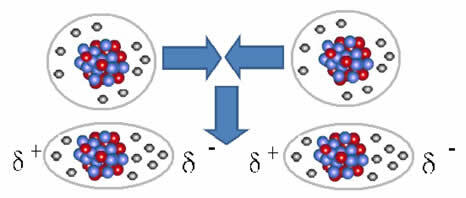
Представлення дипольного утворення в неполярних молекулах
Між цими молекулами утворилися два полюси, а негативний полюс одного взаємодіє з позитивним полюсом іншого. Оскільки ці полюси були створені, це міжмолекулярна сила низької інтенсивності.
Б) постійний дипол
І міжмолекулярна сила що відбувається між молекулами речовини з полярною характеристикою. Прикладами є молекули таких речовин, як HCN, H2O, NH3, CO, CH3Кл.
Союз між цими молекулами відбувається, коли негативний полюс однієї взаємодіє з позитивним полюсом іншого.
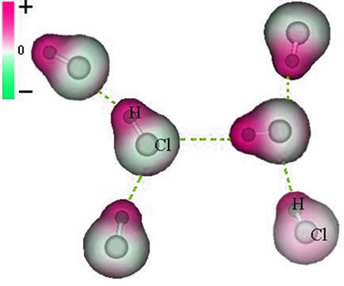
Представлення постійної дипольної сили між молекулами HCl
Оскільки полюси вже існують, постійна дипольна міжмолекулярна сила має більшу інтенсивність, ніж індукований диполь.
ç) водневі зв’язки
Це міжмолекулярна сила це відбувається між полярними молекулами, які мають атом водню, зв’язаний безпосередньо з атомом кисню, азоту або фтору.
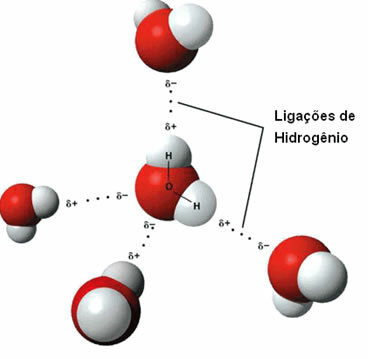
Представлення водневих зв’язків між молекулами води
Водневий зв’язок утворюється, коли водень в одній молекулі взаємодіє з киснем, азотом або фтором іншої молекули.
г) дипольний іон
Ця міжмолекулярна сила виникає між полярною молекулою, яка має пару не зв’язаних електронів, та іоном (катіоном або аніоном) у розчині.
Наприклад, у молекулі води є дві пари не зв’язуючих електронів у кисні. Якщо у водному середовищі є іони, вони наближаються до молекули води, оскільки в ній є полюси.
Не зупиняйтесь зараз... Після реклами є ще щось;)
Важливість
Важливість знання міжмолекулярні сили для Енема це розуміння, яке вони приносять щодо агрегатних станів, температури плавлення, температури кипіння та розчинності речовин.
The) Взаємозв'язок з температурою плавлення та кипіння речовини
Температура плавлення вказує на температуру переходу з твердого в рідкий стан, а температура кипіння - на температуру переходу з рідкого в газоподібний стан.
Цей прохід безпосередньо пов’язаний із взаємодією між молекулами речовини, оскільки те, що відрізняє один агрегатний стан від іншого, це рівень агрегації між його молекулами.
Таким чином, чим інтенсивніша міжмолекулярна сила, тим вище температури плавлення і кипіння. Чим менш інтенсивна міжмолекулярна сила, тим нижче температури плавлення та кипіння. Таким чином, ми можемо визначити порядок спадання температури плавлення і кипіння:
Водневий зв’язок> постійний диполь> індукований диполь
Б) Відношення до розчинності
Загалом, ми повинні знати, що подібно розчиняється подібно, тобто полярна речовина розчиняє полярну речовину, а неполярна речовина розчиняє неполярну речовину.
Однак все ще існує можливість взаємодії між молекулами розчиненої речовини та молекулами розчинника. Це відбувається лише в тому випадку, якщо ця нова взаємодія перевищує те, що вже існує між молекулами самої речовини.
Приклад застосування міжмолекулярної сили у Енема
1-й приклад: (Enem-2011) Шкіра людини, добре зволожена, набуває хорошої еластичності та м’якого і гладкого вигляду. З іншого боку, коли він сухий, він втрачає свою еластичність і здається непрозорим і шорстким. Для запобігання сухості шкіри необхідно, по можливості, використовувати зволожуючі зволожуючі креми, загалом виготовлені з гліцерину та поліетиленгліколю:

Затримка води на поверхні шкіри, що сприяє зволожувачам, є наслідком взаємодії гідроксильних груп змочувачів з вологою, що міститься в навколишньому середовищі через:
а) іонні зв’язки
б) Лондонські сили
в) ковалентні зв’язки
г) диполь-дипольні сили
д) водневі зв’язки
Відповідь на це питання - водневий зв’язок, оскільки молекула води має водень, зв’язаний з атомом кисню. Те саме відбувається з молекулами пропіленгліколю та поліетиленгліколю, що є сприятливою умовою для виникнення цього типу міжмолекулярних сил.
Мені Діого Лопес Діас
Хотіли б ви посилатися на цей текст у школі чи академічній роботі? Подивіться:
ДНІ, Діоґо Лопес. «Міжмолекулярні сили в Енемі»; Бразильська школа. Доступно: https://brasilescola.uol.com.br/quimica/forca-intermoleculares-no-enem.htm. Доступ 27 червня 2021 року.
