В міжмолекулярні сили, узагальнено називається Сили Ван дер Ваальса, є три: індукований диполь-індукований диполь, водневі зв’язки та постійний диполь-постійний диполь. У цьому тексті ми розглянемо лише останню з цих трьох сил:
Потужність постійний дипол-постійний дипол, або просто, диполь-диполь відбувається лише в полярні молекули, тобто ті, що не мають рівномірного розподілу навантаження по своїй поверхні. Наведемо приклад: у молекулі HCl (соляний газ) електронна хмара більше зміщується в бік атома хлору, оскільки вона більш електронегативна, ніж водень.
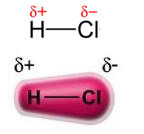
Зверніть увагу, що навколо атома хлору відбувається накопичення електронів, що викликає утворення а негативний полюс, який символізує грецька буква дельта (-δ). В результаті в області навколо атома водню а позитивний полюс (+δ), оскільки він має низьку електронну щільність. Тоді молекула HCl становить а електричний диполь і, отже, при контакті з іншими сусідніми молекулами HCl існує сила притягання між протилежними полюсами молекул, як це видно нижче:
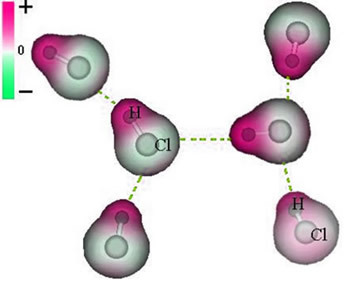
Ця сила притягання, яка встановлюється між негативним кінцем диполя однієї молекули та позитивним кінцем диполя іншої молекули, становить диполь-дипольну силу..
Отже, як випливає з назви, диполь є постійним, тому він зустрічається лише в полярних сполуках. І чим вища полярність молекули, тим інтенсивніше диполь-дипольні взаємодії в речовині.
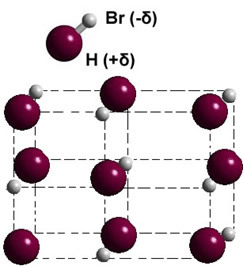
Якщо він знаходиться в твердій фазі, освіта постійного диполя направляє положення кожної молекули в просторі, формуючи диполярні кристали; як у випадку бромістого водню, проілюстрованого нижче:
Іншими прикладами полярних речовин, які мають диполь-дипольну силу між своїми молекулами, є: Н2S, CO, HCCl3, ТІЛЬКИ2.
Ця міжмолекулярна сила є середньої інтенсивності, оскільки він сильніший за індуковану диполем силу дипольного притягання, але менш інтенсивний, ніж водневий зв’язок. Ось чому точки їх плавлення та кипіння вищі, ніж у речовин, що мають індуковану дипольну міцність. Оскільки постійна дипольна сила сильніша, необхідно подавати більше енергії, щоб взаємодії її молекул руйнувалися.
Дженніфер Фогача
Закінчив хімію
Джерело: Бразильська школа - https://brasilescola.uol.com.br/quimica/forca-intermolecular-dipolo-dipolo.htm
