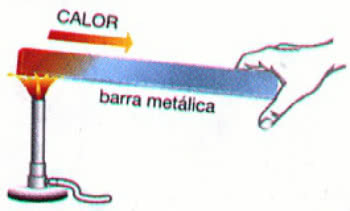
Електроліз це неспонтанний процес, тобто той, який не відбувається природним шляхом, при якому речовини утворюються за допомогою електричного розряду в сполуках, розплавлених або розчинених у воді. У цьому процесі електричний струм досягає скляної ємності (електролітичного бака), яка має два інертні електроди (які не страждають або окислення ні скорочення), утворені графітом або платиною. Ці електроди підключені до електричного джерела (зазвичай a барабани) і занурюють у сіль або основу, розплавлену або розчинену у воді. Так само, як акумулятор, електроліз має катод (де відбувається відновлення) та анод (де відбувається окислення).
Резюме
Електроліз - неспонтанний процес;
Можуть утворюватися прості або композиційні речовини;
Це може відбуватися з розплавленою розчиненою речовиною (магматичний електроліз);
Це може відбуватися з розчиненою у воді розчиненою речовиною (водний електроліз);
Катіон завжди зазнає відновлення на катоді;
Аніон завжди зазнає окислення на аноді.
Дивіться також:Отримання алюмінію при електролізі

Види електролізу
Це електроліз, який відбувається, коли електричний розряд здійснюється на розплавленій іонній сполуці. Іонна сполука - це така, що утворена іонним зв’язком, таким як а сіль або a база неорганічні. Коли ми говоримо про розплавлену сполуку, ми в свою чергу маємо на увазі сполуку, яка переходить із твердого стану в рідкий.
- Приклад магматичного електролізу
Коли ми проводимо злиття хлористого калію (KCl), ця сіль зазнає процесу дисоціації, виділяючи катіон калію (K+) та йодистий аніон (л-).

Рівняння дисоціації для хлористого калію
Коли електричний струм досягає електролізера з цими іонами, катіон калію зменшується, утворюючи металевий калій (K), а аніон йодиду окислюється, утворюючи твердий йод (I2).
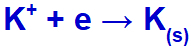
Рівняння утворення твердого калію
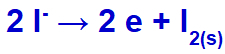
Рівняння утворення твердого йоду
Це електроліз, який відбувається, коли електричний розряд здійснюється на водному розчині (має воду), утвореному соллю або неорганічною основою.
- Приклад водного електролізу
Коли ми розчиняємо хлорид натрію у воді, він дисоціює, і вода зазнає іонізації:

Іонізація води та рівняння дисоціації хлориду натрію
Як катіон натрію (Na+) належить до сімейства IA, катіону гідронію (H+) проходить через розряд і зазнає відновлення, утворюючи газоподібний водень (H2).
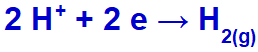
Рівняння газоутворення водню
Як хлорид (Cl-) не окиснюється киснем (не має кисню) і не є фтором (F-), він скидається, окислюючись і утворюючи газоподібний хлор (Cl2).

Рівняння газоутворення хлору
Вибірковий іонний розряд
Під час процесу електролізу у водному середовищі (розчині, утвореному водою та розчиненою речовиною), ми завжди матимемо два катіони: гідроній з води та будь-який інший із дисоціація солі (приклад розчиненої речовини). Ми також матимемо два аніони: гідроксил, який надходить з води, і ще один, який походить від солі.

Іони від іонізації води та дисоціації солі
- Вибірковий розряд для катіонів та аніонів
Якщо катіон із розчиненої речовини належить до сімейства IA, IIA або IIIA, гідроній (H+) буде зменшено;
Якщо катіон, що походить від розчиненої речовини, не належить до вищезазначених сімей, він зазнає зменшення.
Якщо аніон із розчиненої речовини має у своєму складі кисень або являє собою фтор (F-), гідроксид (OH-) зазнає окислення;
-
Якщо аніон із розчиненої речовини не має зазначених вище характеристик, він зазнає окислення.
Не зупиняйтесь зараз... Після реклами є ще щось;)
Відомо, що вода має здатність самоіонізуватися, виробляючи іони гідронію (H+) та гідроксид (OH-), але ця іонізація досить обмежена. Цей факт підтверджується неефективністю чистої води при проведенні електричного струму.
Як от електроліз включає електричний розряд, для проведення електролізу води необхідно розчинити розчинену речовину що сприяє селективному скиданню гідронію та гідроксиду (як видно з теми про скидання вибірково).
Якщо додати сульфат натрію (Na2ТІЛЬКИ4), наприклад, у нас будуть катіони натрію посередині (Na+) та гідронію (H+), а також гідроксид-аніони (OH-) і сульфат (SO4-2). Таким чином, коли електричний струм надходить в електролітичний бак:
гідроній буде скидатися, зменшуючись, оскільки натрій належить до сімейства IA;
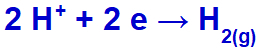
Рівняння газоутворення водню
гідроксид зазнає розряду, окиснення, оскільки сульфат має кисень у своєму складі.
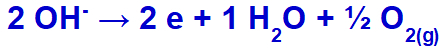
Рівняння газоутворення кисню
Оскільки два іони (катіон та аніон), що надходять з води, були розряджені, ми говоримо, що відбувся електроліз води.
Дивіться теж: Кількісні аспекти електролізу
Виробництво простих речовин, таких як газоподібний водень (H2), кисневий газ (O2) тощо;
Виробництво композиційних речовин, таких як гідроксид натрію (NaOH), сірчана кислота (H2ТІЛЬКИ4) тощо;
Покриття деталі певним металом, таким як мідь (мідь) та золото (золочення);
Використовуйте для видалення певного металу з руди.
Розв’язані вправи з електролізу
Приклад 1 - (Vunesp) Водний розчин CuCℓ2 піддається електролізу, використовуючи платинові електроди. Правильне твердження:
а) Відновлення іонів Cu відбувається на катоді2+.
б) Окислення іонів Cu відбувається на аноді2+.
в) На катоді утворюється хлорний газ.
г) Частина платинового анода розчиняється, утворюючи Pt2+.
д) Продукти цього електролізу були б іншими, якби електроліз CuCl2 був вогненним (синтез).
а) Правильно. Коли CuCl2 розчиняється у воді, маємо катіони гідронію (H+) та мідь II (Cu+2). Оскільки катіон міді II не належить до сімейств IA, IIA та IIIA, він відновлюється.
б) Невірно, оскільки аніон хлориду (Cl) окислюється на аноді-), який не має кисню у своєму складі і не є фтором (F-).
в) Неправда, оскільки відновлення катіона міді II відбувається на катоді, отже, відбувається утворення металу міді.
г) Помилково, оскільки платинові або графітові електроди при електролізі проводять лише електрику, вони не беруть участі в процесі.
д) Помилковий, як магматичний електроліз хлориду міді II (CuCl2) буде представляти точно такі ж продукти, як і водний, оскільки присутніми іонами буде мідь II (Cu+2) і хлорид (Cl-1).
Приклад 2- (UFRN) Розглянемо такі системи:
Я Розплавлений хлорид натрію;
II. Водний розчин натрію хлориду;
III. Плавлений гідроксид натрію;
IV. Водний розчин натрію гідроксиду.
Ті, хто може забезпечити натрій при електролізі, це:
а) лише I та II.
б) лише I та III.
в) лише II та IV.
г) лише III та IV.
д) I, II, III та IV.
Системи, що подають металевий натрій як продукт на катоді, є I та III.
I - Єдиним катіоном, який присутній у середовищі, є катіон натрію, отже, тільки він може відновлюватись, утворюючи металевий натрій.
II- Ця система не передбачає металевий натрій, оскільки хлорид натрію був розчинений у воді, отже, в середині ми маємо присутність катіонів натрію (Na+) та гідронію (H+) - це той, хто зазнає зниження, оскільки натрій належить до сімейства IA.
III - Єдиним катіоном, що присутній у середовищі, є катіон натрію (оскільки матеріал піддався плавленню), отже, тільки він зазнає відновлення, утворюючи металевий натрій;
IV- Ця система не передбачає металевий натрій, оскільки гідроксид натрію розчинявся у воді, тому в середині ми маємо присутність катіонів натрію (Na+) та гідронію (H+) - це той, хто зазнає зниження, оскільки натрій належить до сімейства IA.
Мені Діого Лопес Діас