Газ та пара
Різниця між газом і парою дається від критичної температури. Пара - це речовина в газоподібному стані, стан, який може зріджуватися при збільшенні тиску. Газ - це не те саме. Це рідина, яку не можна зріджувати простим підвищенням тиску. Це робить газ відмінним від пари.
Поведінка газів
Дана речовина в газоподібному стані - це газ, якщо його температура вище критичної температури, якщо температура дорівнює або нижча за критичну температуру, речовиною є пара.
Реальні гази, які ми зазвичай знаємо, такі як гелій, азот та кисень, мають різні та особливі молекулярні характеристики кожного з них. Однак якщо ми покладемо їх на високі температури та низький тиск, вони почнуть демонструвати дуже подібну поведінку. При вивченні газів прийнята проста теоретична модель, якої на практиці не існує, поведінка подібна до поведінки реальних газів. Це наближення стає кращим, чим нижчий тиск і вища температура. Ця модель газу називається ідеальний газ.
Приблизно в 17-19 століттях троє вчених (Жак Шарль, Луї Дж. Гей-Люссак і Пол Е. Клайперон), вивчивши поведінку газів, розробив закони, що регулюють поведінку досконалих газів, які також називають ідеальними газами. Визначені ними закони встановлюють правила "зовнішньої" поведінки ідеального газу, що веде до він враховує лише ті фізичні величини, які з ними пов’язані, а саме: об’єм, температуру та тиску.
Загальний закон досконалих газів
Вираз, що визначає загальний закон ідеальних газів, можна побачити наступним чином:
Не зупиняйтесь зараз... Після реклами є ще щось;)
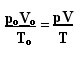
де сО, VО і ТО - початковий тиск, початковий об’єм та початкова температура відповідно. Це вираз, який використовується, коли змінні газу змінюються.
Закон Бойля
Роберт Бойл, фізик і хімік, був тим, хто визначив закон, який регулює перетворення, які зазнає газ, коли його температура підтримується постійною. Його закон говорить, що коли газ зазнає ізотермічного перетворення, його тиск обернено пропорційний займаному об’єму. З цього закону ми отримуємо, що як ТО = Т Ми мусимо:
PОVО = pV
Закон Карла
Закон Чарльза - це закон, який регулює перетворення ідеального газу в постійний об’єм. Ці перетворення називаються ізохоричними або ізометричними перетвореннями. Відповідно до цього закону, коли досконала газова маса зазнає ізохорного перетворення, її тиск прямо пропорційний абсолютній температурі. Математично цей закон можна виразити так:

де сО і ТО - початковий тиск і початкова температура відповідно.
Закон Гей-Люссака
Закон Гей-Люссака - це закон, який регулює перетворення ідеального газу при постійному тиску. Цей закон, незважаючи на назву Гей-Люссак, вже був відкритий фізиком і хіміком А.С.Чарльзом. Відповідно до закону, коли газ зазнає ізобарного перетворення, об’єм газу прямо пропорційний його абсолютній температурі. Математично цей закон можна виразити так:

Де VО і ТО відповідають відповідно початковому об'єму та початковій температурі.
Марко Ауреліо да Сільва
Побачити більше!!
Газові перетворення
Знати, що таке газові перетворення.
Хотіли б ви посилатися на цей текст у школі чи академічній роботі? Подивіться:
САНТОС, Марко Ауреліо да Сільва. «Дослідження газів»; Бразильська школа. Доступно: https://brasilescola.uol.com.br/fisica/estudo-dos-gases.htm. Доступ 27 червня 2021 року.