THE СпочаткуЗакондаєТермодинаміка є додатком принципдаєзбереженнядаєенергія для термодинамічних систем. Відповідно до цього закону, варіація внутрішня енергія термодинамічної системи - це різниця між кількістю тепло поглинається системою та виконаною нею роботою.
Дивисьтакож:Основні поняття та короткий зміст термології
Що таке перший закон термодинаміки?
Перший закон термодинаміки є прямим наслідком принципу збереження енергії. Відповідно до цього принципу, загальна енергія системизавжди залишається постійним, оскільки вона не загублена, а перетворена.
У межах Термодинаміка, використовуються більш конкретні поняття і менш загальні, ніж ті, що використовуються в принципі енергозбереження. У Першому законі термодинаміки ми використовуємо такі поняття, як енергіявнутрішній,тепло і робота, які мають відношення до сфери застосування Теплові машини (технологічні програми, що мають принципове значення для термодинаміки).

Уявіть собі парову машину, коли робоча рідина цієї машини (водяна пара) отримує тепло від зовнішнього джерела, можливі два перетворення енергії: пара може мати свою власну
температури збільшено на кілька градусів або, навіть, може розширювати і рухати поршні цієї машини, виконуючи таким чином певну кількість робота."Варіація внутрішньої енергії термодинамічної системи відповідає різниці між кількістю поглиненого нею тепла та обсягом роботи, яку виконує ця система".
Формула першого закону термодинаміки
Формула, яка використовується для математичного опису Першого закону термодинаміки, наведена нижче:

U - внутрішня зміна енергії (кал або J)
Питання - тепло (вапно або Дж)
τ - робота (вапно або J)
Для того, щоб використовувати цю формулу, нам потрібно звернути увагу на деякі правила сигналів:
ΔU - буде позитивним, якщо температура системи зросте;
ΔU - буде негативним, якщо температура системи знизиться;
Питання - буде позитивним, якщо система поглинає тепло із зовнішнього середовища;
Питання - це буде негативно, якщо система віддає тепло зовнішньому середовищу;
τ – буде позитивним, якщо система розшириться, здійснюючи роботу над зовнішнім середовищем;
τ – це буде негативно, якщо система скорочуватиметься, отримуючи роботу із зовнішнього середовища.
внутрішні зміни енергії
Термін ΔU відноситься до змін енергії, пов'язаних з кінетична енергія складових частинок системи, у випадку ідеального газу, можна сказати, що ΔU еквівалентно:
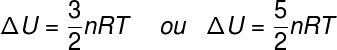
немає - кількість родимок (моль)
Р. - універсальна константа ідеальних газів (0,082 атм. Л / моль. К або 8,31 Дж / моль. К)
Т - абсолютна температура (кельвін)
Аналізуючи формули, можна побачити, що, якщо в системі не відбувається зміни температури, її внутрішня енергія також залишиться незмінним. Крім того, важливо сказати, що для теплових машин, які працюють у циклах, коливання внутрішньої енергії в кінці кожного циклу має бути нульовим, оскільки в цей момент двигун повертається до роботи з початковою температурою.
Дивисьтакож:Продуктивність теплових машин: як вона розраховується?
Тепло
Переходячи до наступного терміну, Q, який відноситься до кількості теплоти, що передається в систему, ми зазвичай використовуємо фундаментальне рівняння калориметрії, показано нижче:
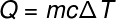
Питання -тепло (вапно або J)
м - маса (г або кг)
ç - питома теплоємність (кал / гºС або Дж / кг. К)
ΔT - коливання температури (за Цельсієм або Кельвіном)
Робота
Останньою з величин, пов'язаних з Першим законом термодинаміки, є робота (τ), яка має a аналітична формула лише для перетворень, що відбуваються під постійним тиском, також відома подібно до ізобаричні перетворення, дивіться:
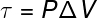
P - тиск (Па або атм)
ΔV - зміна обсягу (м³ або л)
Коли тиск, що чиниться на систему, не є постійним, роботу можна обчислити за площею графіка тиску в залежності від обсягу (Р х V). Щоб дізнатись більше про цю скалярну величину, відвідайте: робота.
розв’язані вправи
Питання 1)(ЦефетMG) Робота, що виконується в замкнутому тепловому циклі, дорівнює 100 Дж, а тепло, задіяне в теплообміні, дорівнює 1000 Дж та 900 Дж відповідно з гарячими та холодними джерелами.
З першого закону термодинаміки зміна внутрішньої енергії в цьому тепловому циклі, в джоулях,
а) 0
б) 100
в) 800
г) 900
д) 1000
Дозвіл
Альтернатива a.
Розв’яжемо вправу, використовуючи Перший закон термодинаміки, зверніть увагу:

Відповідно до заяви, нам пропонується розрахувати зміну внутрішньої енергії в замкнутому термодинамічному циклі, і в цьому випадку ми знаємо, що внутрішня зміна енергії повинна бути нульовою, оскільки машина повернеться до роботи за тієї самої температури, яка була на початку циклу.
Питання 2)(Вгору) Зразок ідеального газу розширюється шляхом подвоєння його обсягу під час ізобаричного та адіабатичного перетворення. Враховуючи, що тиск, який відчуває газ, становить 5,106 Па та його початковий обсяг 2.10-5 м³, можна сказати:
а) Тепло, що поглинається газом під час процесу, становить 25 кал.
б) Робота газу під час його розширення становить 100 кал.
в) Внутрішні зміни енергії газу становлять –100 Дж.
г) Температура газу залишається постійною.
д) Жодне із зазначеного.
Дозвіл
Альтернатива c.
Використовуючи інформацію, надану твердженням про вправу, ми використаємо Перший закон термодинаміки, щоб знайти правильну альтернативу:
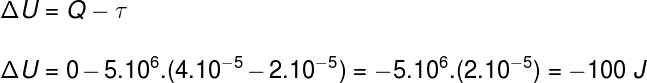
Питання 3)(Ого) Варочна ємність містить газ високого тиску. Коли ми відкриваємо цей балон, ми помічаємо, що газ швидко виходить в атмосферу. Оскільки цей процес дуже швидкий, ми можемо вважати його адіабатичним процесом.
Враховуючи, що Перший закон термодинаміки заданий ΔU = Q - W, де ΔU - зміна енергії всередині газу Q - енергія, що передається у вигляді тепла, а W - робота, яку виконує газ, це правильно зазначити, що:
а) Тиск газу збільшився, а температура знизилася.
б) Робота газу була позитивною, а температура газу не змінювалася.
в) Робота газу була позитивною, а температура газу знизилася.
г) Тиск газу збільшився, а виконана робота була від’ємною.
Дозвіл
Альтернатива c.
Як тільки об’єм газу розширюється, ми говоримо, що виконана робота була позитивною, тобто сам газ виконував роботу на зовнішньому середовищі. Крім того, оскільки процес відбувається дуже швидко, газ не має часу для обміну теплом із оточенням, тому відбувається наступне:
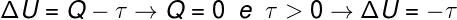
Згідно з розрахунком, внутрішня енергія газу зменшується на величину, що дорівнює виконаній роботі крім газу, крім того, оскільки відбувається зменшення внутрішньої енергії газу, також відбувається зменшення температури.
Питання 4)(Udesc) У фізичній лабораторії проводяться експерименти з газом, який для цілей термодинамічного аналізу можна вважати ідеальним газом. З аналізу одного з експериментів, в якому газ піддавався термодинамічному процесу, було зроблено висновок, що все тепло, яке подається до газу, перетворюється на роботу.
Перевірте альтернативу, яка представляє правильно термодинамічний процес, проведений в експерименті.
а) ізоволюметричний процес
б) ізотермічний процес
в) ізобарний процес
г) адіабатичний процес
д) композитний процес: ізобаричний та ізоволюметричний
Дозвіл
Альтернатива b.
Щоб усе тепло, яке подається до газу, перетворювалось на роботу, не повинно бути поглинання внутрішньої енергії іншими словами, газ повинен пройти ізотермічний процес, тобто процес, який відбувається при температурі постійний.
Рафаелем Хеллерброком
Вчитель фізики
Джерело: Бразильська школа - https://brasilescola.uol.com.br/fisica/primeira-lei-da-termodinamica.htm