ти альдегіди та кетони вони дуже схожі на органічні функції. Обидва мають у своїй структурі карбонільну функціональну групу (C = O), з тією лише різницею, що у випадку альдегідів, він завжди з'являється в кінці вуглецевого ланцюга, тобто одним із карбонільних вуглецевих лігандів є водень; кетони містять карбоніл між двома іншими атомами вуглецю.
Функціональна група альдегідів:Функціональна група кетонів:
О О
║ ║
C C ─ H C C ─ C
З цієї причини існують випадки функціональної ізомерії між альдегідами та кетонами. Наприклад, нижче ми представляємо два функціональні ізомери, що мають однакову молекулярну формулу (C3H6O), але один - це альдегід (пропанал), а інший - кетон (пропанон). Подивіться, як це повністю змінює їх властивості та застосування:
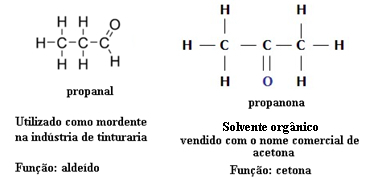
Приклад функціональної ізомерії між альдегідом та кетоном
Уявіть, що ви перебуваєте в лабораторії і знайдете флакон із безбарвною рідиною, що має лише молекулярну формулу С3H6О. Що б ви зробили, щоб дізнатися, це кетон чи альдегід?
Щоб вирішити подібні проблеми,
існують методи диференціювання альдегідів і кетонів, засновані на реакції цих сполук проти слабких окислювачів. Як показано нижче, зіткнувшись зі слабкими окислювачами, альдегіди реагують шляхом окислення, тоді як кетони не реагують. Ми так говоримоальдегіди діють як відновники, а кетони - ні, вони реагують лише як відновники в контакті з енергійними окислювачами.Альдегіди + слабкі окислювачі → карбонова кислота
О О
║ ║
C ─ C ─ H + [O] → C ─ C ─ OH
Кетони + слабкі окислювачі → Не реагувати
О
║
C ─ C ─ C + [O] → Жодної реакції не відбувається
Виходячи з цього, достатньо провести цю реакцію і перевірити, реагує сполука чи ні. Якщо воно реагує, ми знаємо, що це альдегід; якщо він не реагує, це кетон.
Крім того, продукти, що утворюються в цих реакціях окислення альдегіду, цілком помітні, при цьому відбуваються зміни кольору, як це буде показано далі.
Існує три основних методи диференціювання альдегідів та кетонів, а саме:
1- Толленс Реактивний: Цей реагент являє собою аміачний розчин нітрату срібла, тобто він містить нітрат срібла (AgNO3) і надлишок гідроксиду амонію (NH4ОН):
AgNO3 + 3 NH4ОН → Ag (NH3) ОН + NH4БІЛЯ3 + 2 год2О
Толленс Реактив (названий на честь німецького хіміка Бернарда Толленса (1841-1918))
Як пояснюється в тексті Виготовлення срібного дзеркала, коли альдегід вводиться в контакт з реакційно-здатним Толленсом, він окислюється до відповідної карбонової кислоти, тоді як іони срібла відновлюються до Ag0 (металеве срібло). Якщо цю реакцію провести, наприклад, у пробірці, це металеве срібло осіде на стінках пробірки, що призведе до утворення плівки, яка називається срібне дзеркало. Цей спостережуваний результат дуже гарний і використовується в процесі виробництва промислових дзеркал.
Реакцію, яка має місце, можна представити наступним чином:
О О
║ ║
R ─ C ─ H + H2O → R ─ C ─ OH + 2e- + 2 H+
2 Ag+ + 2e- → 2 Ag0
2 NH3 + 2 год+ → 2 NH4+
О О
║║
R C ─ H + 2 Ag+ + 2 NH3 + H2О → R C ─ ОН + 2 Ag0 + 2 NH4+
альдегід Толленс реактивнийкарбонова кислота металеве срібло (срібне дзеркало)
З іншого боку, якщо ми введемо кетон в реакцію з реактивом Толленса, утворення металевого срібла не відбудеться, оскільки кетони не можуть зменшити іони Ag.+.
2- Фелінговий реактив: Цей реактив є синім розчином мідного купоросу II (CuSO4) в основному середовищі, оскільки його змішують з іншим розчином, утвореним гідроксидом натрію (NaOH) та тартратом натрію та калію (NaOOC-CHOH-CHOH-COOK). Тартрат додають до розчину мідного купоросу II для його стабілізації та запобігання його осадження.
CUSO4 + 2 NaOH → Na2ТІЛЬКИ4 + Cu (OH)2
Фелінг Реактив (названий на честь німецького хіміка Германа фон Фелінга (1812-1885))
У контакті з реакційноздатною речовиною Фелінга альдегід утворює карбонову кислоту шляхом її окислення, тоді як іони міді (Cu)2+), присутні в середині, зменшуються, утворюючи червонувато-коричневий осад (більш схожий на цеглу кольору), який є оксидом купруму. Кетони, навпаки, не реагують - оскільки вони не можуть зменшити іони Cu2+.
О О
║ ║
R ─ C ─ H + 2 Cu (OH)2 → R ─ C ─ OH + Дупу2О + 2 год2О
альдегід червоно-коричневий осад
3- Реактив Бенедикта: Цей реактив також утворюється розчином сульфату міді II (Cu (OH)2) в основному середовищі, але його змішують з цитратом натрію.
Як і у випадку з реагентом Фелінга, у випадку реакції між альдегідом та реагентом Бенедикта є також іони міді (Cu2+) присутні в середовищі, які відновлені і утворюють червоний оксид купруму.
Цей реактив широко використовується в тестах для виявлення присутності та вмісту глюкози в сечі. У своїй структурі глюкоза має альдегідну групу, тому вона реагує з реагентом Бенедикта, який присутній у смужках для цих тестів. Потім порівняйте колір стрічки з кольором луски на упаковці товару.

Реагент Бенедикта використовується для визначення вмісту глюкози в сечі.
Дженніфер Фогача
Закінчив хімію
Джерело: Бразильська школа - https://brasilescola.uol.com.br/quimica/diferenciacao-aldeidos-cetonas.htm


