Хлористого-воднева кислота - гідрацид з високим потенціалом іонізації, це жовтувата рідина, сильно їдка і токсична. Застосовується в різних промислових процесах, таких як виготовлення засобів для чищення та фармацевтичних гідрохлоридів, у харчових продуктах та в процесах виробництва сталі.
Він також присутній в організмі людини; О шлунковий сік який діє при травленні білки є розчином кислоти; соляних та інших речовин, таких як ферменти і солі. Вплив, вдихання або проковтування Концентрована соляна кислота дуже шкідлива для здоров'я, що навіть може спричинити смерть.
Читайте також: Сірчана кислота - речовина, що володіє високою корозійною силою
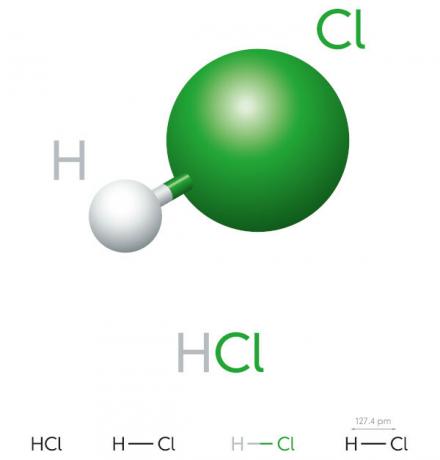
Властивості соляної кислоти
- неорганічна сполука
- сильна кислота
- Високий потенціал іонізації
- Рідина
- жовтуватий вигляд
- Токсичний
- Їдкий
- Нестійкий
- Гігроскопічний (має властивість поглинати áводи навколишнього середовища)
- Розчинний у воді
Не зупиняйтесь зараз... Після реклами є ще щось;)
Виробництво соляної кислоти
Соляна кислота була відкритий мусульманським алхіміком званий Джабір Ібне Хаяне, також відомий як Габер і вважався батьком арабської хімії. Він синтезував речовину на основі а реакція між морською сіллю (NaCl) та сірчана кислота (В2ТІЛЬКИ4).
2NaCl + H2ТІЛЬКИ4 → В2ТІЛЬКИ4 + 2HCl
В даний час соляна кислота виробляється у великих масштабах через електроннийóлізис хлориду натрію у водному розчині. В результаті цього процесу отримують газ хлор (Cl2), газ водень (H2) та їдкий натр (NaOH). Хлор і водень реагують з утворенням соляної кислоти:
Кл2 + H2 → 2HCl
Однак, ця реакція надзвичайно висока екзотермічний і дуже небезпечний. В даний час більша частина соляної кислоти, що виробляється промисловим способом, пов'язана з виробництвом органічних сполук, будучи більш економічним та безпечним процесом.
R-H + Cl2 → R-Cl + HCl
(Вважайте R органічним радикалом.)
Дивіться також: Поради для визначення-якщо сила кислот

Застосування соляної кислоти
- Соління металу: Соляна кислота використовується для «очищення» металів перед їх обробкою, видалення іржі, накипу та інших домішок з їх поверхні.
- Виробництво органічних сполук: соляна кислота використовується як реагент для отримання вінілхлориду, який використовується у виробництві пластмас. Соляна кислота також походить із хлоропрену, який використовується в синтетичних каучуках.
- Виробництво неорганічних сполук: соляна кислота присутня в декількох промислових процесах виробництва реагентів та сполук неорганічні речовини, серед яких є засоби для очищення води, такі як хлорид заліза (III) та алюміній.
- Використовується як засіб для чищення: Соляна кислота, яка продається також як мріятична кислота, використовується для післябудівного, побутового та хімічного очищення інструментів та машин.
- Приготування їжі: Соляна кислота використовується в різних реакціях для виробництва їжі та добавок, таких як гідроліз крохмалю та білків, або в кінцевому продукті для балансу рН.
- Виробництво наркотиків: Соляна кислота використовується у виробництві розчинних гідрохлоридів, присутніх у кількох лікарських препаратах, таких як доксициклін гідрохлорид, що використовується при лікуванні черевний тиф і віспа.
Соляна кислота в організмі
Соляна кислота присутня в нашому Травна система, шлунковий сік, що виробляється нашим шлунком, - це розчин води, ферментів, соляної кислоти, неорганічних солей і невеликого відсотка молочної кислоти.
О харчовий пиріг перетворюється на хімус, кисла маса (завдяки дії шлункового соку та його кислому складу), це коли травлення білки, перетворений на поліпептиди і амінокислоти що поглинеться організмом.
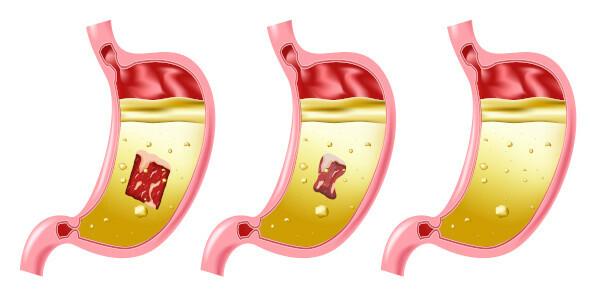
Небезпека соляної кислоти
Соляна кислота є дуже сильною і їдкою кислотою, тому контакт з речовиною спричиняє кілька пошкоджень:
- Шкіра: Викликає опіки та подразнення.
- Очі: Викликає сильне подразнення та може спричинити сліпоту.
- Вдихання: Викликає подразнення та травму верхніх дихальних шляхів.
- проковтування: викликає корозію в порожнині рота, а в шлунково-кишковому тракті може спричинити блювоту, кровотечі, діарею, проблеми з кровообігом, що може призвести до смерті.
- Контактдалі буде: атакує спочатку ділянки слизової, викликаючи дерматит і кон’юнктивіт, кровоточивість ясен, фотосенсибілізація; це може спричинити часте вдихання навіть при низькій концентрації сполуки гастрит і носова кровотеча.
Також доступ: Характеристика та властивості оцтової кислоти

розв’язані вправи
Питання 1 - Щодо соляної кислоти, можна сказати, що:
А) перебуваючи у водному розчині, він дозволяє пропускати електричний струм.
Б) є двокислотою.
В) - слабка кислота.
Г) має низький ступінь іонізації.
Е) є іонною речовиною.
Дозвіл
Альтернатива А. Соляна кислота не є двокислотою, оскільки вона має лише один іонізуючий Н, але один сильна кислота, молекулярна речовина з високим потенціалом іонізації. THE іонізація у водному середовищі сприяє провідності електричний струм завдяки існуванню вільних іонів.
Питання 2 - У розчині соляної кислоти та води можна сказати, що вміст молекулярного хлористого водню (HCl) мінімальний, це тому, що
А) соляна кислота при контакті з водою розбавляється.
Б) хлороводень - речовина, яка не розчиняється у воді.
В) хлороводень має високий потенціал іонізації, отже, коли у водному середовищі молекула HCl утворює іони Н+ Кл-.
Г) соляна кислота, оскільки вона дуже летюча, відокремлюється від розчину, залишаючи лише молекули води.
Д) соляна кислота є іонною речовиною, тому у водному розчині вона дисоціює, утворюючи іони.
Дозвіл
Альтернатива C.
А) Відповідь не узгоджується із запитанням, розведення соляної кислоти у воді не виправдовує відсутності молекулярної HCl.
Б) Неправильно, хлороводень розчинний і має спорідненість до води.
В) Правильно
Г) Хоча соляна кислота є летючою, поділ цих двох видів у розчині не відбувається суттєво.
Д) Соляна кислота - це розчин хлористого водню та води, де хлороводень є неіонною молекулярною речовиною.
Автор: Лайса Бернардес, Marques de Araujo
Вчитель хімії
Хотіли б ви посилатися на цей текст у школі чи академічній роботі? Подивіться:
ARAúJO, Laysa Bernardes Marques de. "Хлористого-воднева кислота"; Бразильська школа. Доступно: https://brasilescola.uol.com.br/quimica/Acido-cloridrico.htm. Доступ 27 червня 2021 року.