Enerjiiç toplamı kinetik enerjiler ve bir cismi oluşturan atomların ve moleküllerin hareketiyle ilgili potansiyel. İç enerji de doğru orantılıdır. sıcaklık vücudun. Joule (SI) cinsinden ölçülen ve aşağıdaki gibi değişkenlerin bir fonksiyonu olarak belirlenen skaler bir niceliktir. basınç (P), Ses (V) ve sıcaklık bir sistemin termodinamiği (T), Kelvin (K) cinsinden.
Bir cismin sıcaklığı ne kadar yüksek olursa, iç enerjisi o kadar büyük olur, bu nedenle bazı işleri yapma yeteneği o kadar büyük olur. Ayrıca, örneğin tek atomlu gazların iç enerjisi, yalnızca kinetik enerji gazın her atomunun İki atomlu gazlar gibi moleküler gazlarla uğraşırken, moleküler etkileşimler dikkate alınmalıdır ve bu, iç enerji, moleküllerin kinetik enerjisinin, aralarında var olan potansiyel enerji ile toplamı tarafından belirlenir. onlar.
Şimdi durma... Reklamdan sonra devamı var ;)
İdeal tek atomlu gazların iç enerjisi
İdeal bir tek atomlu gazın atomları arasında etkileşim olmadığından, iç enerjisi yalnızca iki değişkene bağlıdır: mol sayısı (n) ve gaz sıcaklığı (T). İzlemek:
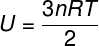
sen - içsel enerji
Hayır - mol sayısı
$ – mükemmel gazların evrensel sabiti
T - sıcaklık
Yukarıdaki denklemde, $ 0.082 atm modülüne sahiptir. L/mol. K veya 8.31 J/mol. K (SI). Ayrıca yukarıdaki denklemi basınç ve hacim gibi diğer nicelikler cinsinden de yazabiliriz. Bunun için hatırlamamız gereken Clapeyron Denklemi, ideal gazlar için kullanılır.
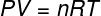
Yukarıdaki denklemi bir öncekinin yerine koyarak, iç enerjinin hesaplanması için aşağıdaki ifadeye sahip olacağız:
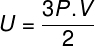
BakAyrıca:Mükemmel gaz nedir?
Yukarıdaki denklemleri dikkate alarak, ideal bir monoatomik gazın atomlarının kinetik enerjisi ile sıcaklığı arasında bir ilişki belirlemek mümkündür. Bunun için bu gaz türünün kinetik enerjisinin yalnızcakinetik. İzlemek:
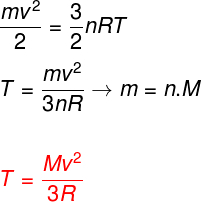
m - makarna
Hayır - mol numarası
M - molar kütle
Birçok durumda, bir gazın iç enerjisinin (ΔU) varyasyonunun nasıl hesaplanacağını bilmek ilginçtir, çünkü bu miktar gazın Alındı veya teslim edildi enerji. Gazın iç enerjisinin değişimi pozitif ise (ΔU > 0) gaz enerji almış olacaktır; aksi halde (ΔU< 0), gaz enerjisinin bir kısmından vazgeçmiş olacaktır.
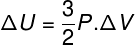
Gaz hacmi değişimi açısından iç enerji değişimi.
İki atomlu gazlar için iç enerji
İdeal iki atomlu gazlar için iç enerji biraz farklı bir denklemle verilir.
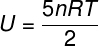
Termodinamik dönüşümler ve döngülerde iç enerji
Göre Termodinamiğin 1. Yasasıİdeal bir gazın iç enerjisi bazı durumlarda değişebilir. termodinamik dönüşümler, sistem tarafından veya sistem üzerinde yapılan işin yanı sıra çevre ile sistem arasındaki ısı alışverişi miktarına bağlı olarak.
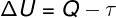
S - sıcaklık
τ - iş
Şimdi, bu yasanın bazı özel termodinamik dönüşümler için aldığı forma bakalım.
BakAyrıca:Termal makinelerin tarihi
→ İç enerji: izotermal dönüşüm
at izotermal dönüşüm, sıcaklık değişimi olmaz ve bu nedenle iç enerji sabit kalır.
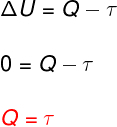
Bu durumda, sistemle değiş tokuş edilen ısı miktarının tamamı işe çevrilir ve bunun tersi de geçerlidir.
→ İç enerji: izovolümetrik dönüşüm
at izovolümetrik dönüşüm, sistem rijit ve genişlemeyen bir konteynır içine hapsedildiği için iş yapmak mümkün değildir. Bu durumda, sistemle değiş tokuş edilen tüm ısı miktarı, iç enerjisini doğrudan değiştirir.
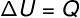
→ İç enerji: izobarik dönüşüm
Bu tür bir dönüşümde, sistem bir sabit basınçbu nedenle, kendisi tarafından veya üzerinde yapılan iş analitik olarak hesaplanabilir.
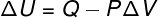
→ İç enerji: adyabatik dönüşüm
İçinde adyabatik dönüşümler, sistem ve çevresi arasında ısı alışverişi yoktur, bu nedenle, iç enerjinin değişimi yalnızca sistem tarafından veya sistem üzerinde yapılan işe bağlıdır.
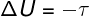
Döngüsel süreçlerde iç enerji
Her döngüsel süreçte, bir sistemin basınç, hacim ve sıcaklık değişkenleri (P, V, T) ile temsil edilen termodinamik durumu, dönüştürülür, ancak orijinal duruma (P, V, T) geri döner, bu nedenle, bu tür bir süreçte iç enerjinin değişimi her zaman sıfırdır (ΔU = 0).
BakAyrıca:döngüsel dönüşümler
A ve B durumları arasındaki üç farklı termodinamik dönüşümü gösteren aşağıdaki grafiğe bakın.
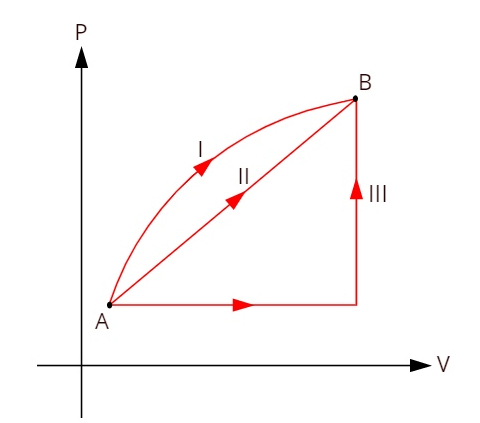
Üç dönüşüm (I, II ve III) A durumundan ayrılıp B durumuna geçerken, iç enerji değişimi hepsi için eşit olmalıdır, bu nedenle:
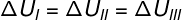
İç enerji egzersizleri
1) Molar kütlesi 24 g/mol'e eşit olan iki mol ideal bir iki atomlu gaz, hacmi 10'a eşit olan kapalı, sert bir kap içinde 500 K sıcaklıkta bulunur.-3 m³. Belirleyin:
a) Bu gazın joule cinsinden iç enerjisinin modülü.
b) Gazın kabın çeperlerine uyguladığı basınç.
Çözüm:
) İdeal ve iki atomlu bir gaz olduğu için iç enerjisini hesaplamak için aşağıdaki formülü kullanacağız:
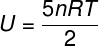
Alıştırma bildiriminde bildirilen verileri alarak aşağıdaki hesaplamayı çözeceğiz:
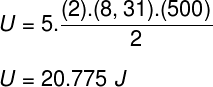
B) İçinde bulunduğu kabın hacmini bildiğimizde gazın uyguladığı basıncı belirleyebiliriz: 10-3 m³. Bunu yapmak için aşağıdaki formülü kullanacağız:
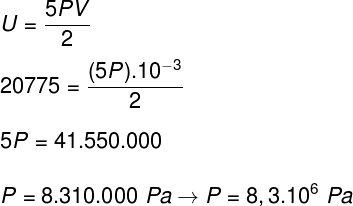
Benden. Rafael Helerbrock